Roztwory buforowe są układami zdolnymi do utrzymywania względnie stałego pH środowiska, a ich składowymi są sprzężone pary kwas-zasada Brønsteda. Gdy do roztworu zawierającego bufor wprowadzi się kwas, wówczas pochodzące z jego dysocjacji jony wodorowe zostaną zneutralizowane w wyniku ich reakcji z zasadą Brønsteda stanowiącą składową buforu. Z kolei, wprowadzając do roztworu pewną liczbę jonów wodorotlenkowych, pochodzących z dysocjacji mocnej zasady, wówczas przereagują one z obecnym w układzie składnikiem buforu jakim jest kwas Brønsteda.
W tzw. buforze fosforanowym kwasem Brønsteda jest wodoroanion, w którym fosfor stanowi 31,9% masy. Wartość pH takiego roztworu można obliczyć z zależności:
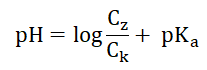
W wyrażeniu tym Ck jest stężeniem molowym kwasu Brønsteda o stałej dysocjacji Ka, natomiast Cz to stężenie molowe sprzężonej z nim zasady.
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2010.
Zmieszano 200 cm3 roztworu diwodoroortofosforanu(V) sodu zawierającego 10,2 g rozpuszczonej soli oraz 50 cm3 roztworu wodoroortofosforanu(V) sodu, w którym stężenie jonów Na+ było równe 0,2 mol∙dm–3.
Oblicz wartość pH uzyskanego buforu fosforanowego. Wynik podaj z dokładnością do cyfry jedności.
Rozwiązanie tego zadania dostępne jest nieodpłatnie pod poniższym linkiem:
© dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone