Roztwory buforowe są układami złożonymi:
– ze słabego kwasu (HA) i jego soli (anion A–) pochodzącej od mocnej zasady, przy czym przyjmuje się, że stężenie jonu A– jest wówczas równe stężeniu soli,
– ze słabej zasady (B) i jej soli (kation BH+) pochodzącej od mocnego kwasu, przy czym przyjmuje się, że stężenie jonu BH+ jest wówczas równe stężeniu soli.
Dla opisanych układów buforowych istnieją zależności:
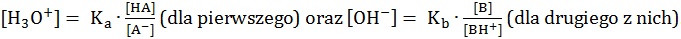
Rola bufora sprowadza się do utrzymania względnie stałego pH roztworu.
Na podstawie: P. W. Atkins, Chemia fizyczna, Warszawa 2012.
W celu sporządzenia pewnego roztworu buforowego, do 200 cm3 0,02-molowego roztworu octanu potasu (CH3COOK) wprowadzono 44,8 cm3 odmierzonego w warunkach normalnych chlorowodoru. Uzyskany roztwór dokładnie wymieszano i umieszczono w kolbie miarowej o pojemności 500 cm3, a następnie uzupełniono wodą destylowaną „do kreski”.
a) Napisz równanie reakcji chemicznej jaka przebiegła po wprowadzeniu chlorowodoru do opisanego roztworu soli.
b) Oblicz wartość pH uzyskanego w opisany sposób w kolbie miarowej roztworu buforowego. Wynik podaj z dokładnością do pierwszego miejsca po przecinku.
© dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone