Obliczanie masy soli niezbędnej do przygotowania roztworu buforu amonowego o określonej wartości pH (bufory)
Roztwory buforowe są układami złożonymi:
– ze słabego kwasu (HA) i jego soli (anion A–) pochodzącej od mocnej zasady, przy czym przyjmuje się, że stężenie jonu A– jest wówczas równe stężeniu soli,
– ze słabej zasady (B) i jej soli (kation BH+) pochodzącej od mocnego kwasu, przy czym przyjmuje się, że stężenie jonu BH+ jest wówczas równe stężeniu soli.
Dla opisanych układów buforowych istnieją zależności:
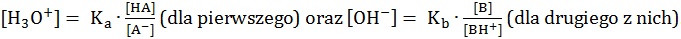
Rola bufora sprowadza się do utrzymania względnie stałego pH roztworu.
Na podstawie: P. W. Atkins, Chemia fizyczna, Warszawa 2012.
W kolbie miarowej o pojemności 1 dm3 umieszczono 500 cm3 20% roztworu wody amoniakalnej o gęstości 0,92 g/cm3.
Jaką ilość chlorku amonu należy odważyć do kolby, aby po uzupełnieniu wodą destylowaną „do kreski” uzyskać bufor amonowy o pH = 11? Wynik obliczeń podaj z dokładnością do trzech cyfr znaczących. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone