Miareczkowanie alkacymetryczne jest metodą stosowaną do ilościowego oznaczania zawartości substancji chemicznej w jej wodnym roztworze. Podczas jego wykonywania, do roztworu analitu o znanej objętości, lecz nieznanym stężeniu molowym ostrożnie wprowadza się znajdujący w biurecie mianowany (o ściśle określonym stężeniu) roztwór titranta. Charakterystyczny podczas miareczkowania jest tzw. punkt równoważnikowy, czyli moment, w którym analit przereagował ilościowo z dodanym z biurety titrantem. Praktycznie w każdym przypadku, podczas miareczkowania, do roztworu analitu wprowadzany jest niewielki nadmiar roztworu titranta, który doprowadzi do trwałej zmiany zabarwienia zastosowanego wskaźnika alkacymetrycznego. Dlatego rzeczywisty punkt końcowy miareczkowania odpowiada wartości pH innej, niż punkt równoważnikowy.
Na podstawie: R. Szczypiński, Projektowanie doświadczeń chemicznych. Dla maturzystów i nie tylko, Warszawa 2019.
W wyniku wykonanego miareczkowania 50 cm3 roztworu kwasu solnego roztworem zasady sodowej o wartości pH równej 13,3 ustalono, że początkowe stężenie analitu wynosiło 0,08 mol∙dm–3.
Zmiany pH miareczkowanego roztworu w zależności od objętości dodanego roztworu titranta można przedstawić graficznie w postaci tzw. krzywej miareczkowania. Rysunki poniżej przedstawiają takie krzywe w trzech różnych układach kwas-zasada, a znajdujące się na nich linie przerywane wskazują wartość pH przy której osiągnięto punkt równoważnikowy.
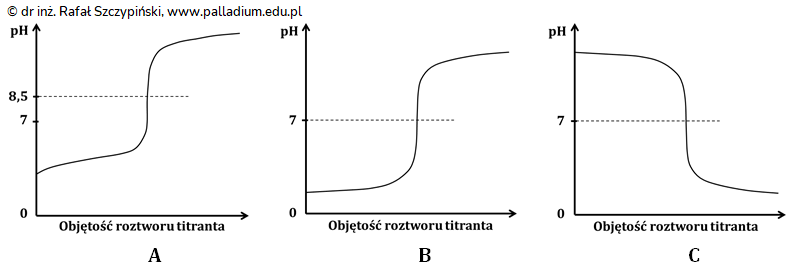
Spośród podanych rysunków tylko jeden może ilustrować zmiany zarejestrowane podczas miareczkowania opisanego w treści wstępnej do zadania. Wybierz te grafiki, które nie ilustrują krzywej miareczkowania sporządzonej podczas tego doświadczenia. Uzasadnij swój wybór.
Wybrany rysunek oraz uzasadnienie:
Wybrany rysunek oraz uzasadnienie:
© dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone