Brak zmiany szybkości reakcji chemicznej pomimo obniżenia temperatury, reguła van't Hoffa. Podręcznik 2.2 zad. 2
Zależność szybkości reakcji chemicznej od temperatury z pewnym przybliżeniem opisuje tzw. reguła van’t Hoffa, którą przedstawia się wzorem:
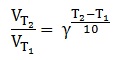
W wyrażeniu tym VT1 oraz VT2 to szybkości reakcji prowadzonych w temperaturach – bazowej (T1) oraz po jej zmianie (T2) – zwiększeniu, bądź zmniejszeniu. Parametr γ to tzw. współczynnik temperaturowy van’t Hoffa, który jest wielkością charakterystyczną dla danej reakcji chemicznej.
Współczynnik temperaturowy van’t Hoffa pewnej biegnącej zgodnie z kinetyką I-rzędu reakcji chemicznej ma wartość równą 2. Przy stężeniu substratu równym 1 mol∙dm–3 początkowa szybkość tej reakcji w temperaturze T1 wynosi 0,15 mol·dm–3·s–1.
Zaproponuj, co należałoby zrobić, aby po obniżeniu temperatury początkowej układu o 20 K, reakcja przebiegła z taką samą szybkością, jak w temperaturze T1, jeśli nie mamy możliwości zastosowania katalizatora? © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone