Przebiegającą w fazie gazowej reakcję syntezy jodowodoru opisuje równanie:
H2(g) + I2(g) ⇄ 2HI(g)
W tabeli zebrano informacje na temat wartości stałych szybkości – opisanej przemiany (k1) oraz reakcji do niej odwrotnej (k2) w temperaturach 500 K oraz 670 K.
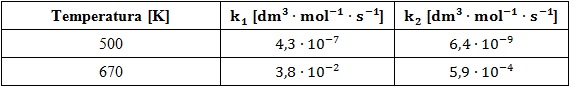
Synteza jodowodoru oraz proces jego rozkładu są reakcjami biegnącymi zgodnie z kinetyką drugiego rzędu, a stałą równowagi pierwszej z nich definiuje się jako stosunek wartości stałej szybkości k1 do wartości k2.
Na podstawie: P. Atkins, L. Jones, Chemia ogólna. Cząsteczki, materia, reakcje, Warszawa 2018 oraz K. M. Pazdro, Zbiór zadań z chemii do liceów i techników. Zakres rozszerzony, Warszawa 2012.
W szczelnie zamykanym reaktorze o pojemności 1 dm3 umieszczono 6,35 g jodu odważonego w warunkach normalnych. Do naczynia tego wprowadzono następnie dwukrotnie większą liczbę moli wodoru odmierzonego w tych samych warunkach ciśnienia i temperatury. Układ reakcyjny ogrzano do temperatury 500 K inicjując reakcję syntezy jodowodoru.
Oblicz szybkość opisanej reakcji chemicznej w temperaturze 500 K, w momencie konwersji w jodowodór 25% początkowej ilości wodoru.
© dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone