Przebiegającą w fazie gazowej reakcję syntezy jodowodoru opisuje równanie:
H2(g) + I2(g) ⇄ 2HI(g)
W tabeli zebrano informacje na temat wartości stałych szybkości – opisanej przemiany (k1) oraz reakcji do niej odwrotnej (k2) w temperaturach 500 K oraz 670 K.
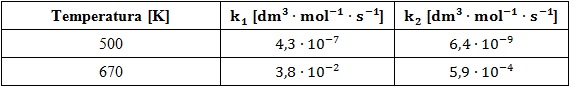
Synteza jodowodoru oraz proces jego rozkładu są reakcjami biegnącymi zgodnie z kinetyką drugiego rzędu, a stałą równowagi pierwszej z nich definiuje się jako stosunek wartości stałej szybkości k1 do wartości k2.
Na podstawie: P. Atkins, L. Jones, Chemia ogólna. Cząsteczki, materia, reakcje, Warszawa 2018 oraz K. M. Pazdro, Zbiór zadań z chemii do liceów i techników. Zakres rozszerzony, Warszawa 2012.
Wartość stałej równowagi reakcji chemicznej zależy od temperatury, ale nie zależy od wartości stężeń reagentów.
Określ, czy przebiegająca w fazie gazowej reakcja syntezy jodowodoru jest procesem egzotermicznym, czy endotermicznym? Uzasadnij swoją odpowiedź.
© dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone