Przeprowadzono doświadczenie chemiczne, którego schemat ilustruje rysunek poniżej.
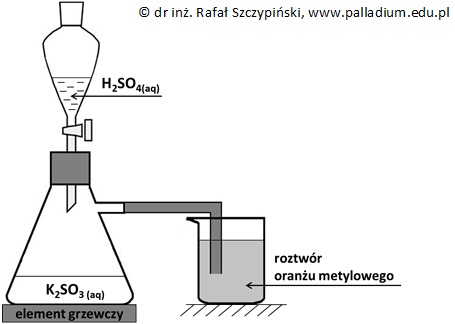
Podczas opisanego doświadczenia, w kolbie przebiegła reakcja chemiczna, której produktem był bezbarwny gaz o drażniącej woni. W wyniku wprowadzania tego związku chemicznego do roztworu oranżu metylowego, między cząsteczkami opisanego gazu i cząsteczkami wody przebiega pewna reakcja chemiczna. W efekcie tworzą się dwa rodzaje drobin – pierwsze z nich mają budowę przestrzenną o kształcie piramidy trygonalnej, a ich dostatecznie wysokie stężenie warunkuje czerwoną barwę roztworów oranżu metylowego. Drugi rodzaj powstałych drobin zawiera atom siarki i może pełnić (w zależności od warunków) rolę kwasu lub zasady Brønsteda.
W celu przeprowadzenia opisanego doświadczenia wykorzystano 100 cm3 20-procentowego roztworu kwasu siarkowego(VI) o gęstości 1,14 g/cm3, który sporządzono rozcieńczając wodą destylowaną stężony (18-molowy) roztwór tego kwasu o gęstości 1,84 g/cm3.
W stężonym (18-molowym) roztworze kwasu siarkowego(VI) znajduje się duża liczba niezdysocjowanych cząsteczek kwasu. Podczas jego rozcieńczania wodą destylowaną, sporządzany roztwór bardzo często osiąga temperaturę wrzenia.
Podkreśl odpowiednie wyrażenia w nawiasach tak, aby powstały zdania prawdziwe.
Podczas rozcieńczania stężonego roztworu kwasu siarkowego(VI) wodą destylowaną, stopień dysocjacji tego kwasu (nie zmienia się / maleje / rośnie). W powstałym roztworze, w porównaniu do stężonego roztworu kwasu liczba jonów będzie (większa / mniejsza / taka sama). Po wzroście temperatury roztworu można wnioskować, że podczas jego rozcieńczania mamy do czynienia z procesem (endotermicznym / egzotermicznym), a sumaryczna wartość entalpii jest wówczas (dodatnia / ujemna / równa zero).
© dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone