Jedną z technik analizy ilościowej jest miareczkowanie konduktometryczne polegające na rejestrowaniu zmian przewodnictwa elektrycznego analizowanego roztworu. Zmiany te widoczne są, gdy do analitu wprowadzany jest titrant zawierający jony, które w sposób znaczący różnią się ruchliwością od jonów znajdujących się w miareczkowanym roztworze. Opisane zmiany przewodnictwa przedstawia się w postaci graficznej, zwanej krzywą miareczkowania. W przypadku miareczkowania roztworu kwasu octowego roztworem NaOH, schemat przebiegu krzywej przedstawia zamieszczony rysunek.
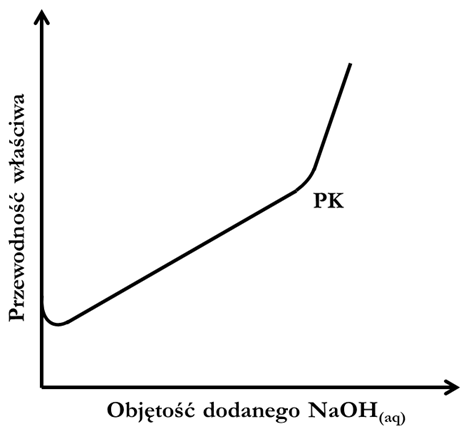
W trakcie tej czynności zachodzi reakcja, w wyniku której w miejsce słabego kwasu octowego pojawia się praktycznie całkowicie zdysocjowany octan sodu. W konsekwencji skutkuje to wzrostem przewodności roztworu. Punkt końcowy (PK) miareczkowania odpowiada stechiometrycznej ilości wprowadzonego titranta względem miareczkowanej substancji.
Na podstawie: W. Szczepaniak, Metody instrumentalne w analizie chemicznej, Warszawa 2012.
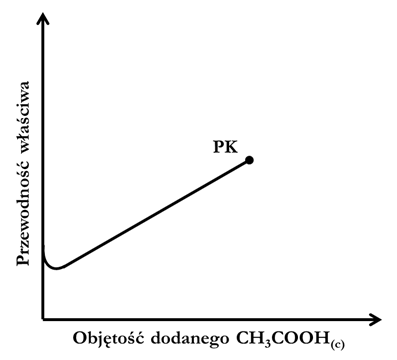
Jeśli zamiast roztworu mocnej zasady, jako titrant zastosowany zostanie kwas octowy, a analizowanym roztworem będzie woda amoniakalna, wówczas po przekroczeniu punktu końcowego, podczas dodawania kolejnych porcji titranta, w układzie obecny będzie roztwór stanowiący mieszaninę octanu amonu oraz praktycznie niezdysocjowanego kwasu.
Na schemacie ilustrującym fragment krzywej miareczkowania roztworu amoniaku kwasem octowym narysuj brakującą część krzywej od momentu, w którym znajduje się punkt końcowy (PK) miareczkowania.
Rozwiązanie tego zadania dostępne jest nieodpłatnie pod poniższym linkiem:
© dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone