Reakcja metanu z dwutlenkiem węgla przebiega zgodnie z równaniem chemicznym:
CH4(g) + CO2(g) ⇄ 2CO(g) + 2H2(g)
W pozbawionym powietrza, szczelnie zamykanym reaktorze o pojemności 10 dm3 umieszczono 22 cm3 „suchego lodu” (stały CO2) o gęstości 1,2 g·cm–3. Następnie w warunkach normalnych odmierzono 6,72 dm3 metanu i przepompowano go do tego samego reaktora, co „suchy lód”. Po całkowitym przesublimowaniu dwutlenku węgla, w pewnych warunkach ciśnienia i temperatury zainicjowano reakcję chemiczną, która przebiegła z 60% wydajnością, co do wartości równą stopniu przereagowania substratu użytego w niedomiarze. W układzie ustaliła się wówczas równowaga dynamiczna, przedstawiona wyżej opisanym równaniem stechiometrycznym.
W dwóch reaktorach o stałej pojemności, takich samych początkowych liczbach moli substratów oraz takich samych początkowych warunkach ciśnienia i temperatury przeprowadzono reakcję metanu z tlenkiem węgla(IV). W pewnym momencie t trwania każdego z procesów, gdy układy osiągnęły stan równowagi dynamicznej wykonano pewne czynności mające na celu zaburzenie równowag.
Reaktor nr 1: wprowadzono kilka moli metanu (CH4).
Reaktor nr 2: zwiększono ciśnienie.
Po pewnym czasie od wykonania opisanych czynności, w układach ustaliły się nowe stany równowagi. Podczas opisanego doświadczenia badano zmiany liczb moli metanu oraz wodoru, które zobrazowano na kilku spośród podanych schematów (A÷D).
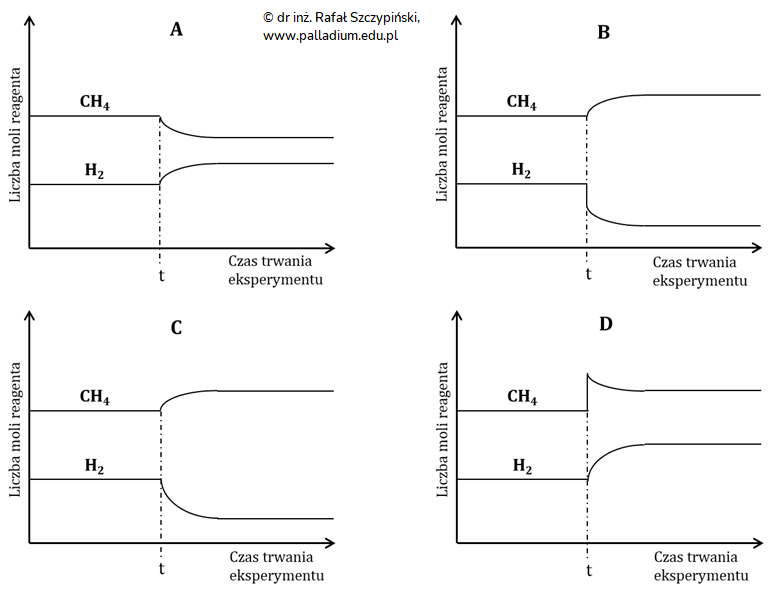
Dla każdego z reaktorów wybierz oznaczenie literowe tego schematu, który najlepiej obrazuje zmiany liczb moli wodoru oraz metanu w danym reaktorze.
Reaktor nr 1:
Reaktor nr 2:
© dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone