Dla reakcji drugiego rzędu istnieje relacja opisana równaniem t1/2·k·Co = 1, w którym: t1/2 to czas połowicznej przemiany (przereagowania), k – stała szybkości reakcji, natomiast Co – początkowe stężenie substratu.
W pewnej temperaturze stała szybkości reakcji rozkładu bromku nitrozylu wynosi 0,8 dm3·mol-1·s-1. Proces ten jest reakcją drugiego rzędu, biegnącą zgodnie z równaniem:
2NOBr(g) ⇄ 2NO(g) + Br2(g)
Na podstawie: P. W. Atkins, Chemia fizyczna, Warszawa 2012.
Podczas zajęć laboratoryjnych dwie grupy studentów miały za zadanie ustalić pojemność reaktorów chemicznych oraz ocenić jej wpływ na początkową szybkość reakcji rozkładu 0,04 mola bromku nitrozylu. Każda z grup przeprowadziła po 10 serii pomiarowych, których celem było określenie czasów połowicznej przemiany substratu. Wyniki eksperymentu zebrano w tabeli:
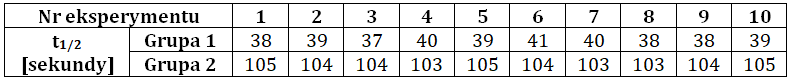
Określ, w którym z reaktorów reakcja przebiegała z większą szybkością? Określ jego pojemność oraz podaj wartość początkową szybkości reakcji wraz z jednostką.
© dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone