Obliczanie zmiany krotności szybkości reakcji w danym momencie jej przebiegu względem szybkości początkowej
Czas, w którym ilość substancji zmniejsza się o połowę nazywamy czasem połowicznej przemiany (przereagowania). W zależności od rzędowości reakcji, wyrażenie opisujące tę wielkość przyjmuje postać:
t1/2 = 0,693/k dla reakcji I-rzędu
t1/2 = 1/(k·Co) dla reakcji II-rzędu
t1/2 = 3/(2·k· Co2) dla reakcji III-rzędu
W podanych równaniach wielkość k jest stałą szybkości reakcji chemicznej, natomiast Co to początkowe stężenie substratu.
W stałej temperaturze T badano szybkość pewnej reakcji chemicznej biegnącej zgodnie z kinetyką I-rzędu. Wyniki eksperymentu zebrano w tabeli.
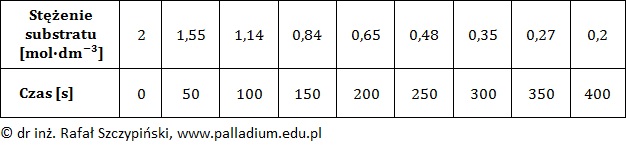
Opisana przemiana przebiegła według schematu:
2A(g) ⟶ 3B(g) + C(g)
Określ, jak zmieniła się szybkość tej reakcji w momencie wykonania ostatniego pomiaru, w stosunku do szybkości początkowej? Odpowiedź uzasadnij obliczeniami. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone