W zależności od wartości pH, w wodnym roztworze dominuje jedna z kilku możliwych struktur fenoloftaleiny (Fen). W przypadku roztworów o pH w zakresie 8,2÷12, które zawierają ten wskaźnik obserwuje się ich malinowe zabarwienie. W silnie alkalicznym środowisku (pH > 12) fenoloftaleina stopniowo przekształca się w postać trójujemnego anionu (FenOH3–), co po pewnym czasie prowadzi do całkowitego odbarwienia się roztworu. Opisaną reakcję można przedstawić wówczas schematycznym równaniem:
Fen2– + OH– ⇄ FenOH3–
Z uwagi na bardzo wysokie w stosunku do jonu Fen2– stężenie jonów wodorotlenkowych przyjmuje się, że zmiana ich liczby praktycznie nie wpływa na szybkość całego procesu, a równanie kinetyczne opisanej reakcji przyjmuje wówczas postać:
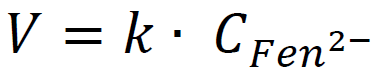
Na podstawie: L. Nicholson, Kinetics of the fading of phenolphthalein in alkaline solution, Journal Of Chemical Education 1989.
W pewnej temperaturze T stała szybkości opisanej przemiany wynosi 0,01·s–1. Na poniższym wykresie przedstawiono zmianę stężenia jonu Fen2– w czasie trwania reakcji jego konwersji do postaci FenOH3–.
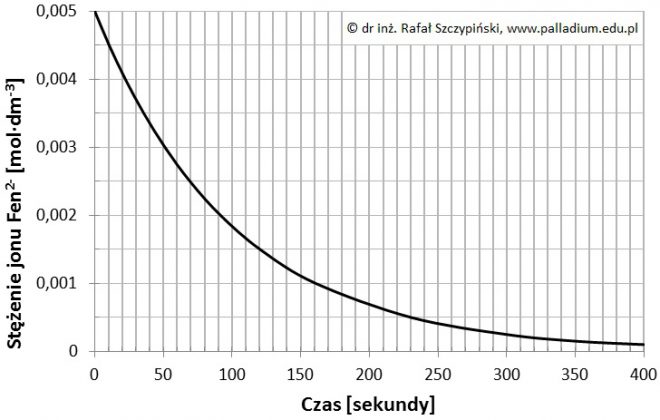
Szybkość reakcji chemicznej definiuje się jako zmianę stężenia substratu w określonym przedziale czasowym.
Oblicz szybkość opisanej reakcji chemicznej w ciągu pierwszych dwóch minut przebiegu oraz podaj jej jednostkę uwzględniając, że czas odmierzano w minutach.
© dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone