Dla reakcji przebiegającej w ogniwie:
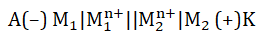
wyrażenie opisujące siłę elektromotoryczną w temperaturze 298 K przyjmuje postać:
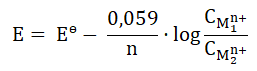
W wyrażeniu tym Eө to standardowa (obliczona dla stanu standardowego) siła elektromotoryczna ogniwa, natomiast 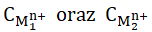 to stężenia molowe kationów metali. Miarą skłonności reakcji do zachodzenia jest wyrażona w dżulach (J) entalpia swobodna, którą w przypadku ogniw chemicznych opisuje wyrażenie:
to stężenia molowe kationów metali. Miarą skłonności reakcji do zachodzenia jest wyrażona w dżulach (J) entalpia swobodna, którą w przypadku ogniw chemicznych opisuje wyrażenie:
ΔG = –n·F·E
W podanym wzorze F jest stałą Faradaya, natomiast w obu wymienionych wzorach n to liczba moli elektronów wymienionych między utleniaczem i reduktorem. Gdy wartość zmiany entalpii swobodnej jest ujemna, proces przebiega samorzutnie, a jeśli ΔG = 0, układ znajduje się w stanie równowagi chemicznej, co w praktyce oznacza, że ogniwo zostało wyczerpane. Dodatnia wartość zmiany entalpii swobodnej informuje, że reakcja może przebiegać już tylko w sposób wymuszony.
P. W. Atkins, L. Jones, Chemia ogólna. Cząsteczki, materia, reakcje, Warszawa 2018.
W pewnej chwili, w ogniwie kadmowo-niklowym stwierdzono, że stężenie jonów Cd2+ wynosi 0,025 mol·dm–3, natomiast jonów Ni2+ 0,011 mol·dm–3.
Ustal na podstawie niezbędnych obliczeń, czy od podanego momentu, w temperaturze 298 K z ogniwa tego można w dalszym ciągu czerpać energię elektryczną.
© dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone