Jedną z przemysłowych metod wytwarzania cynku jest redukcja jego tlenku:
ZnO + C → Zn + CO
W trakcie prowadzonego procesu przebiegają również dwie wpływające na jego całkowitą wydajność reakcje chemiczne:
Reakcja A: ZnO(s) + CO(g) ⇄ Zn(g) + CO2(g)
Reakcja B: CO2(g) + C(s) ⇄ 2CO(g)
Rysunek poniżej ilustruje charakterystyki zmian równowagowego składu fazy gazowej złożonej z CO oraz CO2 pod ciśnieniem 0,1 MPa dla reakcji A oraz B. Zakreskowane pole nad krzywą A obrazuje obszar trwałości cynku, natomiast pole pod tą krzywą jest obszarem trwałości ZnO.
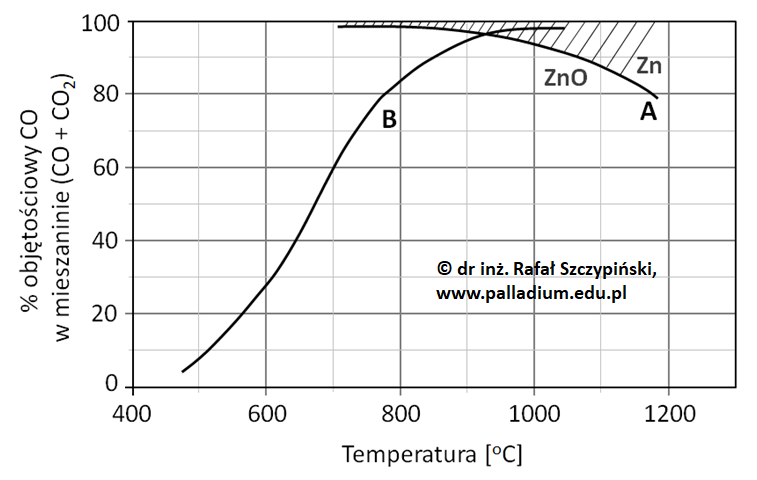
Z zamieszczonych charakterystyk wynika, że w temperaturze powyżej 930 oC stężenie równowagowe CO jest dostatecznie wysokie, aby mogła przebiegać reakcja A.
Na podstawie: K. Schmidt-Szałowski, M. Szafran, E. Bobryk, J. Sentek, Technologia chemiczna.Przemysł nieorganiczny, Warszawa 2013.
Oceń, czy wydajność tworzenia się par cynku w reakcji A rośnie ze wzrostem temperatury? Uzasadnij odpowiedź.
Ocena:
Uzasadnienie:
© dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone