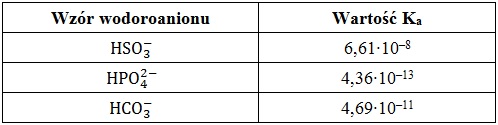
W określonych warunkach wodoroaniony mogą być klasyfikowane jako kwasy Brønsteda. Miarą mocy tych kwasów jest wielkość zwana stałą równowagi dysocjacji kwasowej (Ka). W tabeli poniżej zebrano dane na temat wartości stałych dysocjacji (Ka) w temperaturze 25 oC kilku wybranych wodoroanionów.
Na podstawie: K.-H. Lautenschläger, W. Schröter, A. Wanninger, Nowoczesne kompendium chemii, Warszawa 2018. oraz W. Mizerski, Tablice chemiczne, Warszawa 2013.
W trzech kolejno ponumerowanych (1–3) kolbach miarowych o pojemności 250 cm3 rozpuszczono w 200 cm3 wody destylowanej po 0,01 mola wodorosoli, przy czym były to odpowiednio KHSO3, K2HPO4, KHCO3. Każdy z uzyskanych roztworów uzupełniono następnie wodą destylowaną „do kreski”.
Z kolb zawierających wodne roztwory – wodorosiarczanu(IV) potasu oraz wodoroortofosforanu(V) potasu pobrano próbki o objętości 5 cm3 i umieszczono w dwóch różnych probówkach. W roztworach tych zanurzono następnie uniwersalne papierki wskaźnikowe i stwierdzono, że w naczyniu zawierającym wodorosól pochodzącą od słabszego kwasu wieloprotonowego papierek przyjął zielononiebieskie, a w drugim z naczyń czerwone zabarwienie. Za opisane barwy papierków wskaźnikowych odpowiadają dwa różne procesy przebiegające z udziałem wodoroanionów oraz cząsteczek wody.
Napisz w formie jonowej skróconej równanie procesu, jaki przebiegł w tej probówce, w której zaobserwowano pojawienie się czerwonego zabarwienia papierka wskaźnikowego.
© dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone