Chloral jest związkiem chemicznym o następującej strukturze cząsteczek:
W jego wodnym roztworze przebiega reakcja chemiczna, której równowaga przesunięta jest w kierunku tworzącego się diolu:
CCl3CHO + H2O ⇄ CCl3CH(OH)2
W środowisku o odczynie zasadowym opisana przemiana chemiczna przebiega o wiele szybciej, dlatego w próbie Tollensa udział biorą zwykle cząsteczki diolu, a nie aldehydu. Proces przebiega wówczas w kilku etapach:
1. CCl3CH(OH)2 + OH− → CCl3(CHOH)O− + H2O
2. CCl3(CHOH)O− + [Ag(NH3)2]+ → CCl3(CHOH)OAg + 2NH3
3. CCl3(CHOH)OAg → CCl3(HCOH)O• + Ag
4. CCl3(CHOH)O• + [Ag(NH3)2]+ → CCl3COOH + NH4+ + NH3 + Ag
5. CCl3COOH + OH– → CCl3COO– + H2O
Szybkość przedstawionego procesu zależy od szybkości tworzenia się rodnika.
Podczas badania kinetyki reakcji utleniania opisanego diolu odczynnikiem Tollensa wykonano między innymi dwa eksperymenty w tej samej temperaturze, przy stałej wartości pH roztworu. W trakcie pierwszego z nich zbadano wpływ stężenia kationów diaminasrebra(I) na szybkość tej przemiany chemicznej, przy stałym początkowym stężeniu chloralu. Dane zebrano w tabeli.

Po wykonaniu drugiego eksperymentu, w sposób graficzny przedstawiono zależność szybkości reakcji utleniania diolu od stężenia tego alkoholu przy stałym stężeniu odczynnika Tollensa.
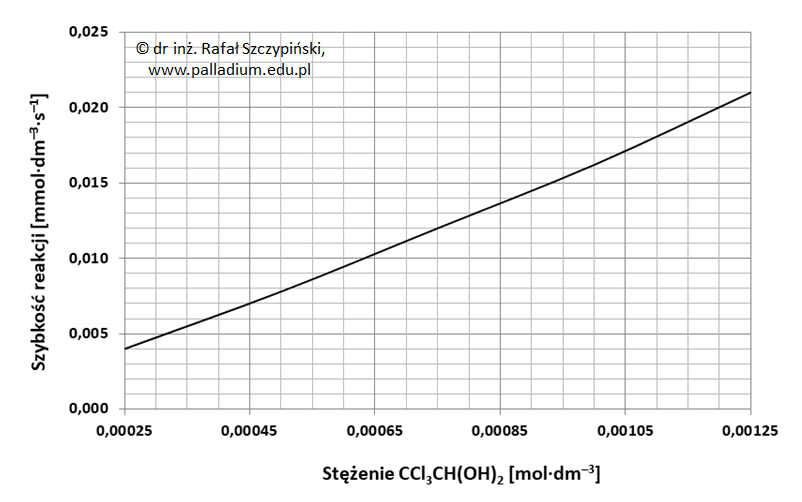
Na podstawie: W. E. Benet, G. S. Lewis, L. Z. Yang and D. E. Peter Hughes, The mechanism of the reaction of the Tollens reagent, Londyn 2011.
Podkreśl wyrażenia w nawiasach, aby powstały zdania prawdziwe.
Szybkość reakcji utleniania diolu (zależy / nie zależy) od stężenia jonów diaminasrebra(I), dlatego względem tych drobin jest to reakcja (zerowego / pierwszego) rzędu. Jednocześnie wraz ze (spadkiem / wzrostem) stężenia diolu obserwujemy praktycznie (liniowy / wykładniczy) wzrost szybkości reakcji jego utleniania. Można zatem wnioskować, że względem tego związku polihydroksylowego jest to reakcja rzędu (zerowego / pierwszego / drugiego).
© dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone