Zamieszczone rysunki przedstawiają struktury cząsteczek oraz nazwy zwyczajowe dwóch związków chemicznych o właściwościach detonacyjnych.
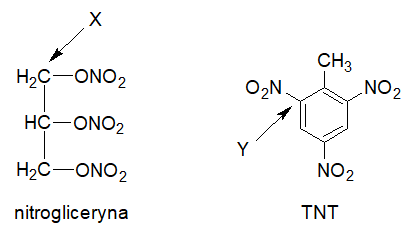
Pomimo, że przedstawione substancje otrzymuje się z wykorzystaniem stężonych roztworów – kwasu azotowego(V) oraz siarkowego(VI), związki te nie należą do tej samej klasy substancji organicznych. W temperaturze 20 oC pod ciśnieniem normalnym nitrogliceryna jest oleistą cieczą o gęstości 1,6 g∙cm–3, która pod wpływem fali uderzeniowej z detonatora ulega rozkładowi:
4C3H5(NO3)3(c) → 6N2(g) + O2(g) + 12CO2(g) + 10H2O(g)
Standardowa entalpia opisanej przemiany wynosi –385 kJ∙mol–1.
Na podstawie: P. Atkins, L. Jones, Chemia ogólna. Cząsteczki, materia, reakcje, Warszawa 2018 oraz W. Mizerski, Tablice chemiczne, Warszawa 2013.
Przeprowadzono rozkład 497 cm3 nitrogliceryny odmierzonej w temperaturze 20 oC pod ciśnieniem normalnym.
Na podstawie niezbędnych obliczeń ustal, ile razy objętość zajmowana przez gazowe produkty rozkładu nitrogliceryny (T = 500 oC, p = 1013 hPa) jest większa od podanej objętości nitrogliceryny odmierzonej w temperaturze 20 oC pod ciśnieniem normalnym. Wynik podaj z dokładnością do cyfry jedności.
© dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone