Pallad jest metalem leżącym w 10. grupie układu okresowego pierwiastków chemicznych. Jego związki chemiczne znalazły liczne zastosowania nie tylko w przemyśle chemicznym, ale również w układach analitycznych. Na przykład chlorek palladu(II) obecny jest w detektorach czadu – silnie toksycznego, bezbarwnego, bezwonnego gazu, który wykazuje około 200-krotnie silniejszą zdolność do wiązania się z zawartymi w hemoglobinie jonami żelaza niż tlen. Niektóre detektory opisanego gazu wyposażone są w ogniwa chemiczne o określonej wartości SEM, którego wartość ulega zmianie w momencie, gdy w powietrzu znajdującym się w pomieszczeniu obecny będzie tlenek węgla(II). Zmiana wartości SEM ogniwa powoduje natychmiastowe uruchomienie sygnału alarmowego urządzenia. Opisane działanie czujnika możliwe jest ze względu na różnice potencjałów elektrochemicznych półogniw:
Pd2+ + 2ē ⇄ Pd Eo = 0,915 V
CO2 + 2H3O+ + 2ē ⇄ CO + 3H2O Eo = –0,52 V
Na podstawie: J. M. Berg i inni, Biochemia, Warszawa 2022 oraz W. Mizerski, Tablice chemiczne, Warszawa 2013.
Wzór elektronowy cząsteczki tlenku węgla(II) można zilustrować rysunkiem:
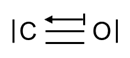
Kationy żelaza(II) obecne w hemoglobinie przyłączają cząsteczki CO wykorzystując obecną w atomie węgla niewiążącą parę elektronową. W ten sposób tworzą się kompleksy zwane karboksyhemoglobiną.
Uwzględniając sposób, w jaki tworzy się opisane wiązanie chemiczne podaj jego nazwę.
© dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone