Woda ulega procesowi autodysocjacji zgodnie z równaniem:
H2O + H2O ⇄ H3O+ + OH–
Równowagę jaka się wówczas ustala opisuje wielkość Kw zwana iloczynem jonowym wody, który w temperaturze 25 oC ma wartość 10–14 i wyraża się w sposób następujący:
Kw = [H3O+]·[OH–]
Gdy do chemicznie czystej wody wprowadzony zostanie roztwór kwasu lub zasady, wówczas dochodzi do zmiany stężenia kationów wodoru oraz anionów wodorotlenkowych powstałych w wyniku autodysocjacji wody. W przypadku roztworów kwasów i zasad, których stężenia są mniejsze niż 10–6 mol·dm–3, w precyzyjnych obliczeniach pH należy wówczas uwzględnić opisaną zmianę.
Na podstawie: A. Hulanicki, Reakcje kwasów i zasad w chemii analitycznej, Warszawa 2016.
Poniższy wykres przedstawia charakterystykę zmian wartości pH (25 oC) roztworu wodorotlenku potasu w zakresie stężeń od 1 mol∙dm–3 do 10–6 mol∙dm–3.
Z uwagi na proces autodysocjacji wody, stężenie jonów wodorotlenkowych w roztworze KOH o stężeniu 10–7 mol∙dm–3 ma wartość 1,62-krotnie większą niż stężenie jonów K+.
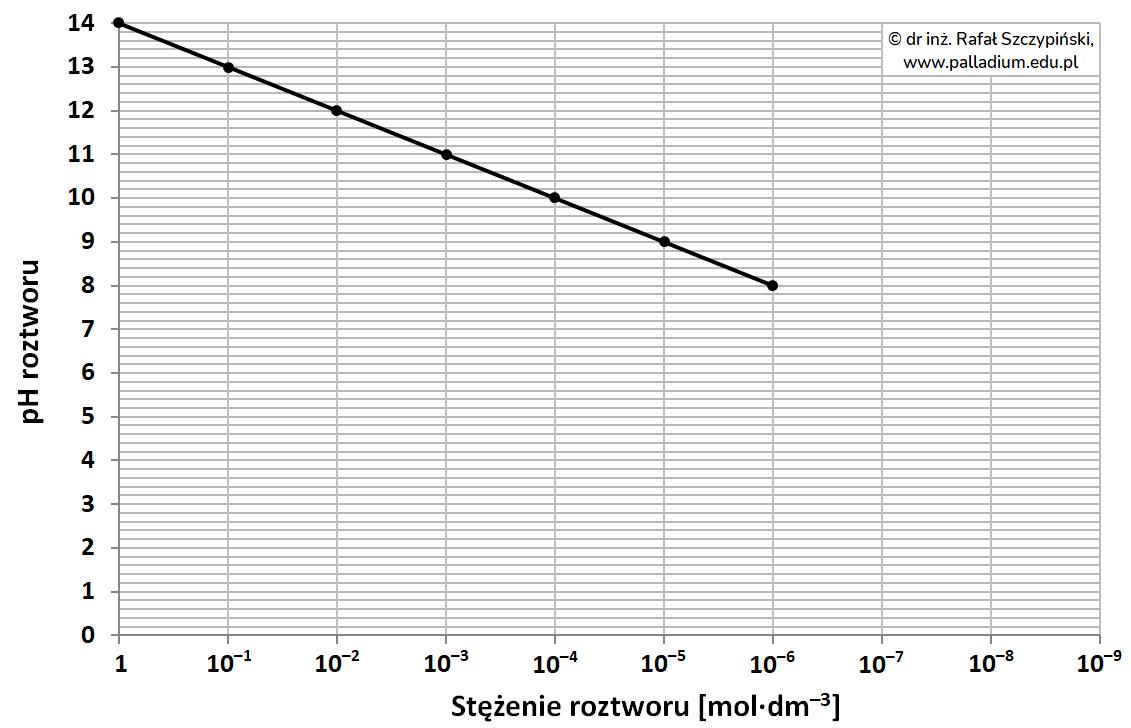
Uwzględniając opisaną wartość stężenia jonów wodorotlenkowych wynikającą z autodysocjacji wody, dorysuj na powyższym szablonie brakujący fragment wykresu w zakresie stężeń roztworu KOH od 10–6 mol∙dm–3 do 10–9 mol∙dm–3.
© dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone