Obliczanie procentu wagowego węglanu magnezu w osadzie. Zadanie 9. Arkusz CKE chemia pokazowy marzec 2022 rozszerzony (2 punkty)
W pewnej wodzie mineralnej znajdują się jony: Ca2+, Mg2+ oraz HCO3–. Ich zawartość przedstawiono w poniższej tabeli.
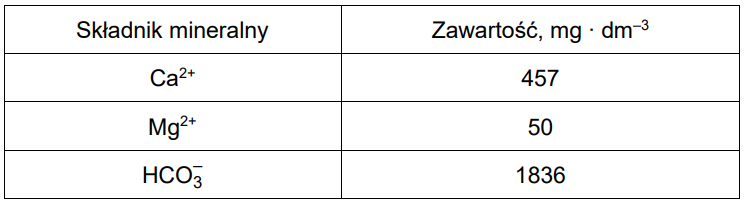
Podczas gotowania 1000 cm3 tej wody mineralnej zaobserwowano powstanie białego osadu. W opisanych warunkach przebiegły reakcje opisane równaniami:
Ca2+ + 2HCO3– → CaCO3 + CO2 + H2O
Mg2+ + 2HCO3– → MgCO3 + CO2 + H2O
Oblicz, jaki procent masy wydzielonego osadu stanowi masa węglanu magnezu. Przyjmij, że obie reakcje zachodzą z wydajnością równą 100%, a powstały osad składa się wyłącznie z węglanu wapnia i węglanu magnezu.