Obliczanie masy osadu na podstawie znajomości rozpuszczalności reagujących ze sobą soli. Zadanie 21. Arkusz CKE chemia maj 2021 rozszerzony (2 punkty)
Na wykresie przedstawiono zależność rozpuszczalności w wodzie dwóch soli – K2CrO4 i Pb(NO3)2 – od temperatury.
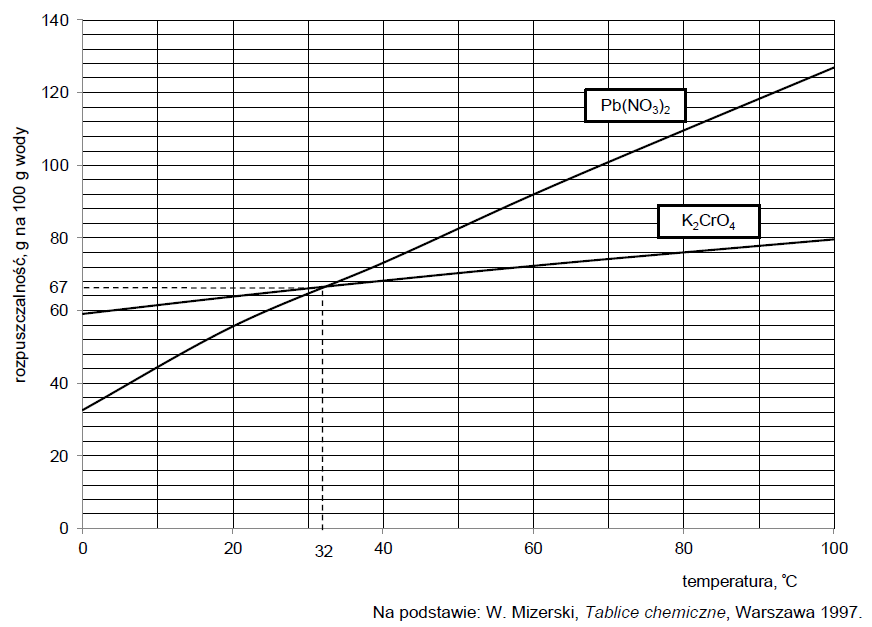
Do 100 gramów nasyconego roztworu azotanu(V) ołowiu(II) o temperaturze 32 °C dodano 100 gramów nasyconego roztworu chromianu(VI) potasu o temperaturze 32 °C. W wyniku przemiany zilustrowanej poniższym równaniem wytrącił się osad.
Pb2+ + CrO42– → PbCrO4
Oblicz masę otrzymanego osadu. Wskaż substancję użytą w nadmiarze – podaj jej wzór lub nazwę. Przyjmij, że opisana przemiana przebiegła z wydajnością równą 100%. Masy molowe są równe: M K2CrO4 = 194 g∙mol–1, M Pb(NO3)2 = 331 g∙mol–1, M PbCrO4 = 323 g∙mol–1. Masa osadu: W nadmiarze użyto: