Wskazanie probówek, w których przygotowano roztwory buforowe. Zadanie 13.2. Arkusz CKE chemia maj 2020 rozszerzony (1 punkt)
Roztwory zawierające porównywalne liczby drobin kwasu Brønsteda i sprzężonej z nim zasady są nazywane roztworami buforowymi. Przykładem jest bufor octanowy. Kwasem Brønsteda są w nim cząsteczki CH3COOH, a zasadą – jony CH3COO– pochodzące z całkowicie zdysocjowanej soli, np. octanu sodu. Wprowadzenie do roztworu buforowego mocnego kwasu skutkuje zmniejszeniem stężenia zasady i wzrostem stężenia sprzężonego z nią kwasu. Dodatek mocnej zasady prowadzi do zmniejszenia stężenia kwasu i wzrostu stężenia sprzężonej zasady. Wartość pH buforu praktycznie nie zależy od jego stężenia i nieznacznie się zmienia podczas dodawania niewielkich ilości mocnych kwasów lub mocnych zasad.
Przeprowadzono doświadczenie, w którym zmieszano jednakowe objętości wodnych roztworów różnych substancji. Wszystkie roztwory miały jednakowe stężenie molowe. Mieszaniny przygotowano zgodnie z poniższym schematem.
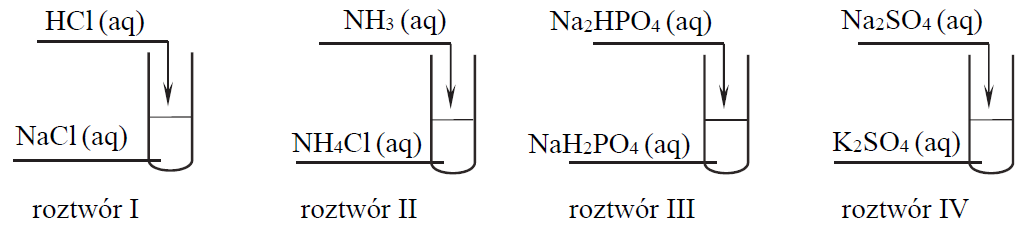
Które z przygotowanych roztworów są buforami? Napisz ich numery.