Wskazanie przybliżonej wartości energii dysocjacji wiązania C–H. Zadanie 18a. Arkusz CKE chemia maj 2013 rozszerzony (1 punkt)
Energia dysocjacji wiązania C–H w alkanach (wyrażona w kJ·mol–1) to energia, jaką trzeba dostarczyć, aby przekształcić 1 mol alkanu w 1 mol atomów wodoru i 1 mol odpowiedniego rodnika organicznego. Przykłady takich procesów oraz odpowiadające im energie dysocjacji zestawiono w poniższej tabeli.
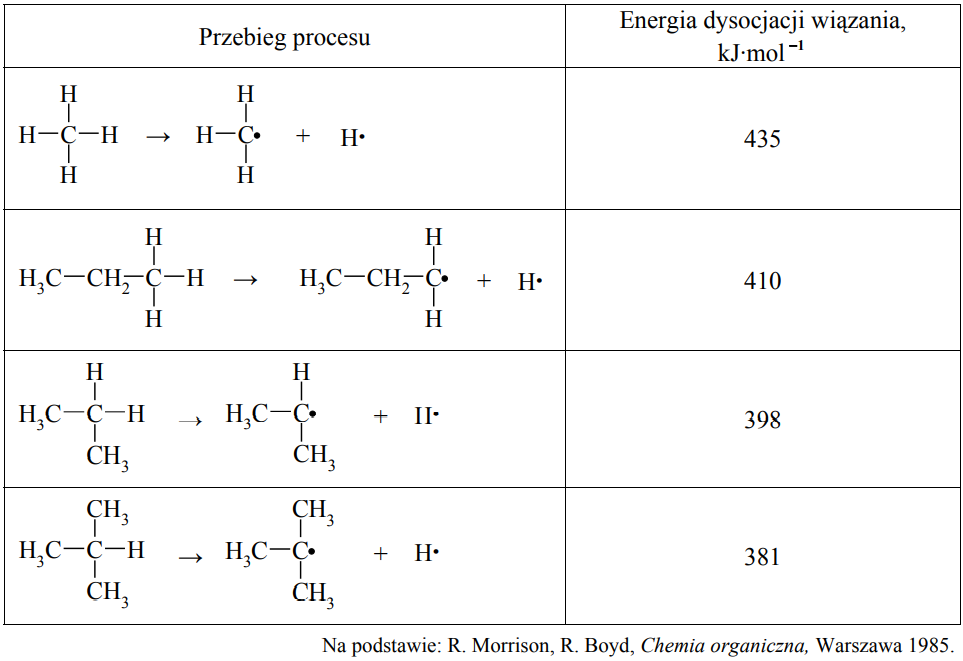
Można zauważyć, że łatwość odrywania atomu wodoru od cząsteczki alkanu zależy od rzędowości atomu węgla, z którym jest on połączony.
Korzystając z informacji, podkreśl przybliżoną wartość energii dysocjacji wiązania C–H w etanie. 435 kJ·mol–1 410 kJ·mol–1 398 kJ·mol–1 381 kJ·mol–1