Obliczenie chwilowej szybkości reakcji utleniania. Zadanie 5. Arkusz CKE chemia czerwiec 2024 rozszerzony (4 punkty) zadanie problemowe
Równanie kinetyczne wyznacza się doświadczalnie. W tym celu dokonuje się wielokrotnego pomiaru szybkości reakcji przy zmianie stężenia tylko jednego z reagentów. Takie postępowanie pozwala określić, jak zmiana stężenia wpływa na wartość szybkości reakcji. Przeprowadzono trzy doświadczenia, w których określono początkową szybkość reakcji przebiegającej w temperaturze T według równania:
S2O82− (aq) + 3I− (aq) → 2SO42− (aq) + I3− (aq)
Równanie kinetyczne przedstawionego procesu ma postać: 𝑣 = 𝑘 ∙ CS2O82−𝑚 ∙ CI–𝑛. Wartości stężenia jonów S2O82− i I− oraz uzyskane wartości początkowej szybkości zaniku jonów S2O82− podano w poniższej tabeli. Przedstawione dane pozwoliły określić współczynniki 𝑚 i 𝑛 w równaniu kinetycznym tej reakcji.
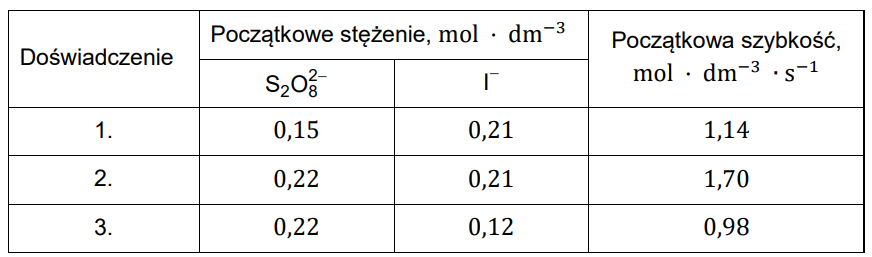
Na podstawie: L. Jones, P. Atkins, Chemia ogólna. Cząsteczki, materia, reakcje, Warszawa 2004.
Oblicz szybkość reakcji (wyrażoną w jednostce: mol · dm−3 · s−1) w doświadczeniu 1. w chwili, gdy w wyniku zachodzącej reakcji stężenie jonów S2O82− obniży się do wartości 0,10 mol · dm−3.