Wybór ucznia wraz z uzasadnieniem, który sformułował właściwy wniosek dotyczący szybkości reakcji chemicznej. Zadanie 5. Arkusz CKE chemia czerwiec 2023 rozszerzony (1 punkt)
W roztworze alkoholowo-wodnym zawierającym bromometan oraz wodorotlenek sodu przebiega reakcja opisana równaniem:
CH3Br + OH− → CH3OH + Br−
Zależność szybkości tej reakcji od stężeń reagentów przedstawia równanie kinetyczne:
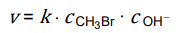
W temperaturze 55 °C wartość k jest równa 2,14 · 10–2 dm3 · mol–1 · s–1.
Na podstawie: R.T. Morrison, R.N. Boyd, Chemia organiczna, Warszawa 1996.
Opisaną reakcję otrzymywania metanolu prowadzono w jednakowej temperaturze w dwóch roztworach (I i II) o równej początkowej liczbie moli jonów OH– i bromometanu. Wskutek użycia większej ilości rozpuszczalnika objętość roztworu II była dwukrotnie większa.
Trzej uczniowie – oznaczeni jako A, B i C – sformułowali wnioski dotyczące wpływu różnicy objętości roztworów na początkową szybkość reakcji. Wnioski poszczególnych uczniów zapisano w tabeli.

Rozstrzygnij, który uczeń (A, B czy C) sformułował poprawny wniosek. Odpowiedź uzasadnij. Poprawny wniosek sformułował uczeń: Uzasadnienie: