Przeprowadzono ciąg kilku reakcji chemicznych, co ilustruje schemat:
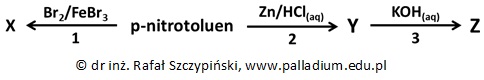
Rozważając wodne roztwory, między kwasem Brønsteda, a sprzężoną z nim zasadą istnieje pewna relacja opisana wyrażeniem zwanym iloczynem jonowym wody (Kw), który w temperaturze 25 ⁰C ma wartość około 10–14:
Kw = Ka ∙ Kb
W przypadku wodnych roztworów soli pochodzących od mocnego kwasu i słabej zasady, w opisanym wyrażeniu Ka to stała równowagi reakcji hydrolizy kationu (kwas Brønsteda), natomiast Kb to stała dysocjacji sprzężonej z nim zasady. Na przykład stała dysocjacji związku chemicznego Z w temperaturze 25 ⁰C wynosi 1,21∙10–9, a nasycony w tych warunkach jego wodny roztwór ma stężenie molowe równe 0,069 mol∙dm–3.
Na podstawie: R. Szczypiński, Projektowanie doświadczeń chemicznych. Dla maturzystów i nie tylko, Warszawa 2019 oraz W. Mizerski, Tablice chemiczne, Warszawa 2013.
Wiedząc, że w opisanych warunkach reakcji hydrolizy ulega mniej niż 5% jonów, oblicz wartość pH roztworu związku chemicznego Y o stężeniu molowym równym stężeniu nasyconego roztworu związku chemicznego Z. Wynik obliczeń podaj z dokładnością do pierwszego miejsca po przecinku.
© dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone