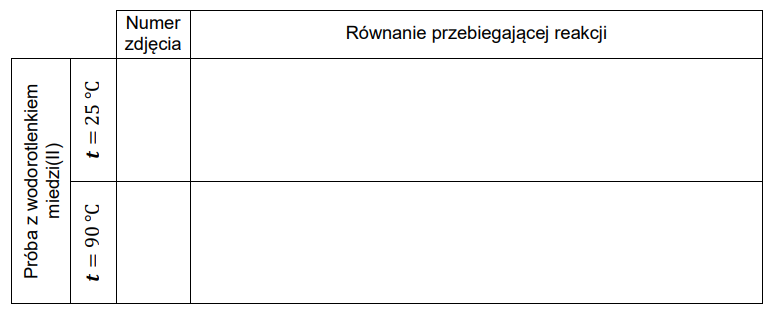
Wskazanie modelu przedstawiającego budowę cząsteczki na podstawie obliczeń. Zadanie 1. Zbiór zadań problemowych CKE z chemii (4 punkty)
O atomie pierwiastka X wiadomo, że:
– 20 spośród wszystkich elektronów w atomie opisanych jest liczbą kwantową 𝑙 = 2,
– elektrony walencyjne atomu X w stanie podstawowym opisane są dwiema różnymi wartościami pobocznej liczby kwantowej (𝑙 = 0 i 𝑙 = 1), przy czym liczba elektronów walencyjnych opisanych poboczną liczbą kwantową 𝑙 = 1 jest większa, niż liczba elektronów walencyjnych opisanych poboczną liczbą kwantową 𝑙 = 0,
– tylko jeden z elektronów walencyjnych jest niesparowany.
Pierwiastek X reaguje z chlorem, w wyniku czego powstaje związek, w którym procentowa masowa zawartość chloru wynosi 45,6 %.
Wykonaj odpowiednie obliczenia i wskaż model, który przedstawia budowę przestrzenną cząsteczki związku pierwiastka X z chlorem. Model:
Określanie wzoru halogenopochodnej fenolu na podstawie rentgenografii. Zadanie 2. Zbiór zadań problemowych CKE z chemii (4 punkty)
Rentgenografia strukturalna jest jedyną techniką badawczą, która pozwala, z niemal absolutną pewnością, określać struktury przestrzenne związków chemicznych (np. dokładną strukturę skomplikowanych cząsteczek związków organicznych). Ta technika polega na naświetlaniu kryształu badanego związku promieniami rentgenowskimi. Uzyskany obraz, nazywany obrazem dyfrakcyjnym, poddaje się zaawansowanej obróbce matematycznej, dzięki czemu można wygenerować mapę rozkładu gęstości chmury elektronowej w cząsteczce, która mówi o wzajemnym ułożeniu w przestrzeni atomów tworzących cząsteczkę. Do uzyskanego obrazu można następnie dopasować najbardziej prawdopodobny model cząsteczki.
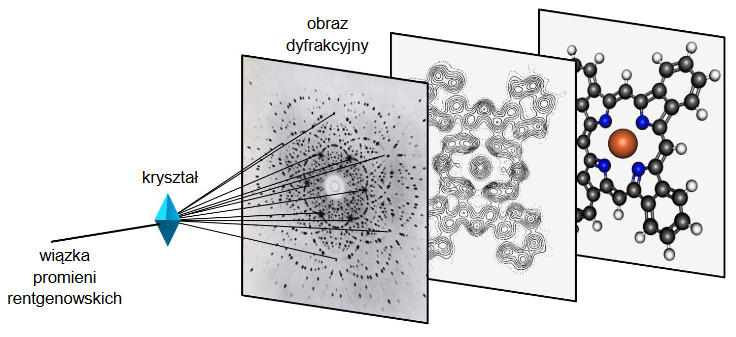
Na podstawie: J.M. Robertson, I. Woodward, J. Chem. Soc. 1937, 219–230.
Poniżej przedstawiono mapę gęstości elektronowej uzyskaną metodą rentgenografii strukturalnej dla pewnej halogenopochodnej fenolu (hydroksobenzenu) zawierającej masowo 15,3 % węgla.
Wykonaj odpowiednie obliczenia i narysuj wzór strukturalny cząsteczki badanego związku oraz podaj jego nazwę systematyczną. Nazwa systematyczna: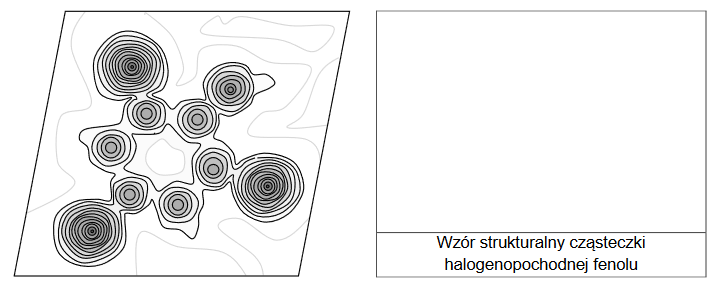
Rysowanie zmian stężeń reagentów po wprowadzeniu reagenta A. Zadanie 5. Zbiór zadań problemowych CKE z chemii (4 punkty)
W zamkniętym reaktorze w stałej objętości (V = 1,00 dm3 ) znajduje się początkowa ilość gazowego substratu A równa 𝑛oA = 1,100 mol. Układ ogrzano do temperatury 550 °C, co zapoczątkowało reakcję rozkładu substratu A do gazowego produktu B. Układ termostatowano przez pewien czas, do ustalenia się równowagi dynamicznej pomiędzy reagentami A i B.
Na wykresie przedstawiono wyniki pomiaru stężeń reagentów A i B w trakcie trwania reakcji do momentu ustalenia się stanu równowagi dynamicznej w podanej temperaturze. Po trzydziestu minutach od momentu osiągnięcia stanu równowagi do reaktora wprowadzono dodatkowo 0,800 mol reagenta A.
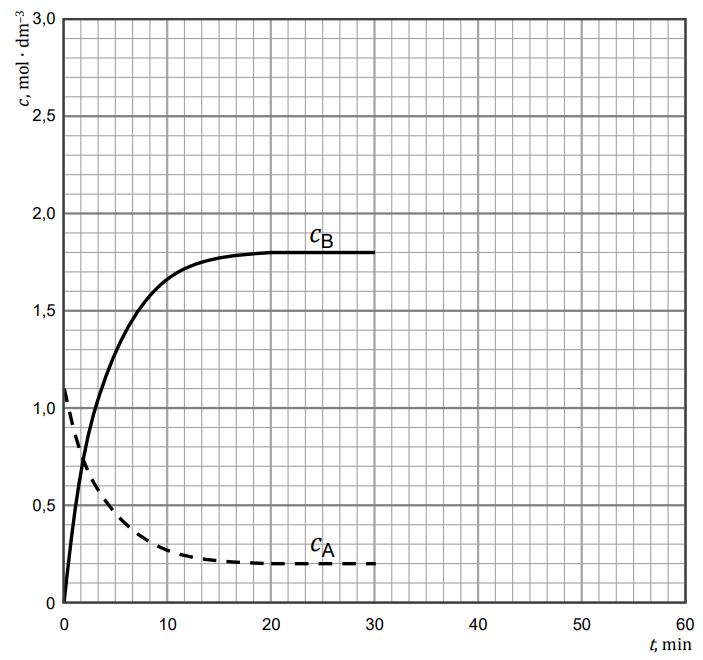
Uzupełnij wykres tak, aby przedstawiał zmiany stężeń reagentów A i B w czasie trwania reakcji, od momentu wprowadzenia do układu dodatkowej ilości reagenta A (𝒕 = 𝟑𝟎 𝐦𝐢𝐧) do momentu zakończenia eksperymentu (𝒕 = 𝟔𝟎 𝐦𝐢𝐧).
Obliczanie stałej równowagi dimeryzacji kwasu octowego. Zadanie 6. Zbiór zadań problemowych CKE z chemii (4 punkty)
Cząsteczki kwasu etanowego mogą łączyć się wiązaniami wodorowymi i tworzyć dimer:
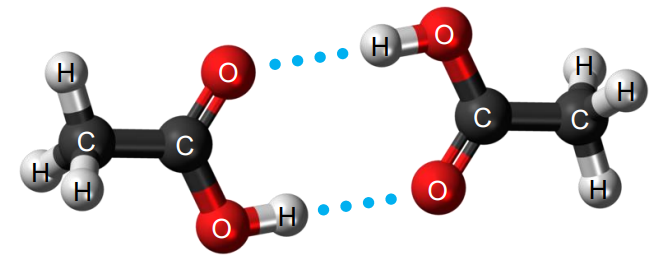
Ten dimer występuje w stanie gazowym oraz w roztworach kwasu etanowego w rozpuszczalnikach nietworzących z nim wiązań wodorowych. Roztwór 60,0 g kwasu octowego (1,00 mol) w 100,0 g benzenu wykazuje temperaturę wrzenia wyższą o 20,1 °C względem wrzenia czystego benzenu. Podwyższenie temperatury wrzenia rozpuszczalnika jest proporcjonalne do łącznej liczby drobin substancji rozpuszczonej w rozpuszczalniku. Tę zależność opisuje poniższy wzór:
![]()
gdzie ∆𝑡 to różnica temperatury wrzenia roztworu i czystego rozpuszczalnika (wyrażona w °C), 𝑛 – sumaryczna liczba drobin w roztworze (wyrażona w molach), 𝑚r – masa rozpuszczalnika (wyrażona w kilogramach), a 𝐾b – stała ebulioskopowa, której wartość dla benzenu wynosi 2,51 °C∙kg∙mol–1 .
Oblicz stężeniową stałą równowagi reakcji: 2CH3COOH ⇄ (CH3COOH)2 w temperaturze T. W obliczeniach pomiń autodysocjację kwasu octowego i przyjmij, że otrzymany roztwór CH3COOH w benzenie miał gęstość równą 0,96 g∙cm–3.
Uzupełnienie tabel na podstawie reakcji z udziałem jonów miedzi(II) oraz chlorkowych. Zadanie 7. Zbiór zadań problemowych CKE z chemii (4 punkty)
W roztworze zawierającym jony Cu2+ oraz jony Cl– ustala się równowaga przedstawiona poniższym równaniem:
Cu2+(aq) + 4Cl–(aq) ⇄ CuCl42–(aq) Δ𝐻>0
Przygotowano roztwór zawierający jony Cl–(aq), Cu2+(aq) i CuCl42–(aq), przy czym stężenia dwóch ostatnich były sobie równe. Temperatura roztworu wynosiła 25 °C. Następnie roztwór ogrzano do temperatury 80 °C. Na zdjęciach poniżej przedstawiono wygląd roztworu w temperaturze 25 °C i w temperaturze 80 °C.

Uzupełnij poniższą Tabelę 1. Następnie w Tabeli 2. wpisz numer zdjęcia przedstawiającego wygląd probówki z roztworem jonów Cu2+ i CuCl42– o temperaturze 25 °C po dodaniu kilku cm3 cieczy wymienionych w tej tabeli.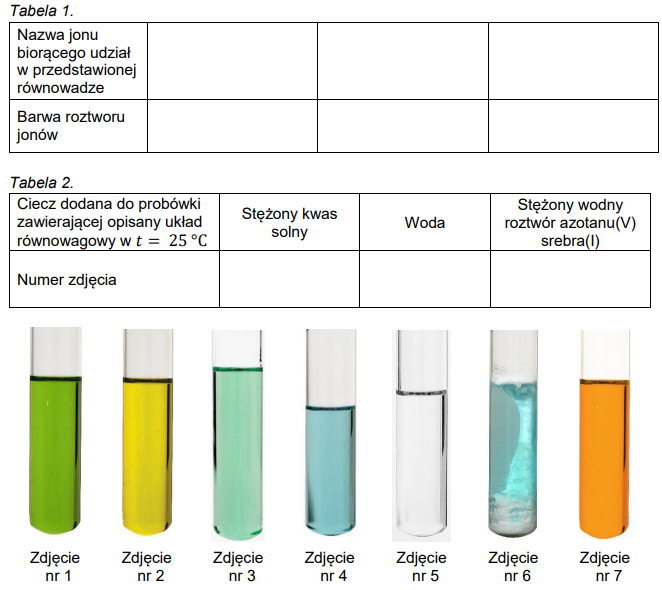
Obliczanie masy hydratu soli ceru niezbędnej do przygotowania roztworu o określonym stężeniu jonów ceru(IV). Zadanie 9. Zbiór zadań problemowych CKE z chemii (4 punkty)
Cer może tworzyć związki chemiczne wyłącznie na +III (bezbarwne sole) albo na +IV stopniu utlenienia (związki czerwono-pomarańczowe). Roztwory soli ceru(IV) można stosować do miareczkowania wszystkich substancji organicznych i nieorganicznych o właściwościach redukujących. Roztwory zawierające kation Ce4+ otrzymuje się poprzez rozpuszczenie w wodzie lub rozcieńczonym kwasie siarkowym(VI) dwuwodnego siarczanu(VI) amonu ceru(IV) (NH4) 4Ce(SO4) 4 ∙ 2H2O, który dysocjuje całkowicie na jony amonowe, ceru(IV) i siarczanowe(VI). Substancją zalecaną do ustalenia dokładnej wartości stężenia molowego kationów Ce4+ (nastawienia miana roztworu) jest tlenek arsenu(III) As2O3. Reakcja pomiędzy jonami ceru(IV) a tlenkiem arsenu(III) prowadzi do powstania kwasu arsenowego(V) H3AsO4 i odbarwienia roztworu.
W celu ustalenia stężenia molowego pewnej substancji organicznej przygotowano roztwór mianowany jonów ceru Ce4+ poprzez rozpuszczenie 𝑚𝑥 gramów dwuwodnego siarczanu(VI) amonu ceru(IV) w wodzie destylowanej i dopełnienie roztworu wodą do całkowitej objętości równej 1,000 dm3 . Podczas nastawiania miana roztworu jonów ceru Ce4+, 200,0 cm3 tego roztworu przereagowało dokładnie z 1,790 g tlenku arsenu(III).
Oblicz, ile gramów dwuwodnego siarczanu(VI) amonu ceru(IV) zużyto do przygotowania roztworu mianowanego kationów ceru(IV).
Rozstrzygnięcie na podstawie obliczeń, czy strąci się osad chloranu(VII) potasu. Zadanie 10. Zbiór zadań problemowych CKE z chemii (4 punkty)
Większość soli potasu jest dobrze lub bardzo dobrze rozpuszczalna w wodzie. Jedną z nielicznych soli potasu słabo rozpuszczalnych w wodzie jest chloran(VII) potasu. Iloczyn rozpuszczalności tej soli, w temperaturze 20 °C, wynosi 𝐾S(KClO4) = 1,05 · 10–2. Z tego powodu aniony chloranowe(VII) są odczynnikiem stosowanym w jakościowej analizie chemicznej do wykrywania obecności kationów potasu. Pojawienie się białego osadu, po dodaniu do badanego roztworu kilku cm3 nasyconego roztworu chloranu(VII) sodu, świadczy o obecności kationów potasu w tym roztworze:
K+ + ClO4– ⟶ KClO4 ↓
Rozpuszczalności chloranu(VII) sodu w wodzie, w temperaturze 20 °C, wynosi RNaClO4 = 205 g/100 g wody, a gęstość nasyconego roztworu tej soli w temperaturze 20 °C wynosi 𝑑r.nas. NaClO4 = 1,58 g∙cm–3.
Na podstawie: CRC Handbook of Chemistry and Physics 90 th Edition, CRC Press 2009.
Rozstrzygnij, czy dodanie 2,00 cm3 nasyconego (w temperaturze 20 °C) roztworu chloranu(VII) sodu do 15,00 cm3 roztworu chlorku potasu o stężeniu molowym równym 0,020 mol ∙ dm–3 spowoduje, że wytrąci się osad chloranu(VII) potasu. Załóż, że objętość otrzymanej mieszaniny jest sumą objętości roztworów przed zmieszaniem. Odpowiedź uzasadnij odpowiednimi obliczeniami.