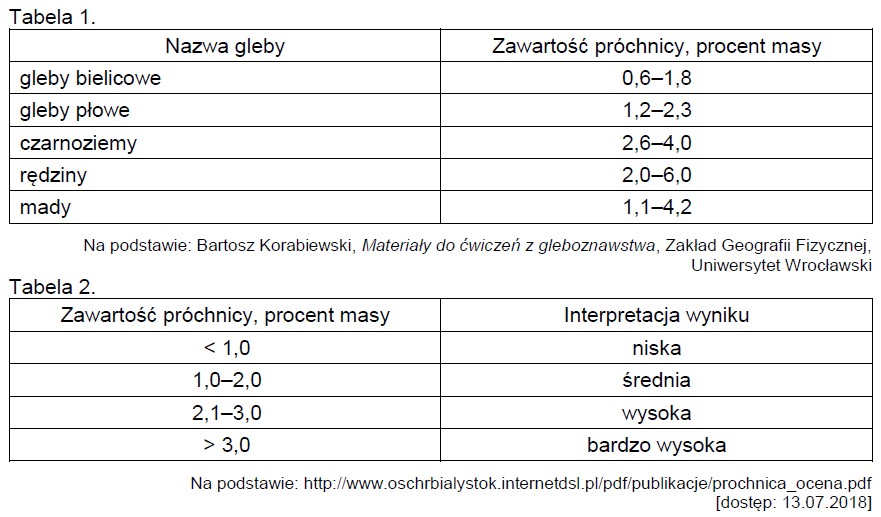
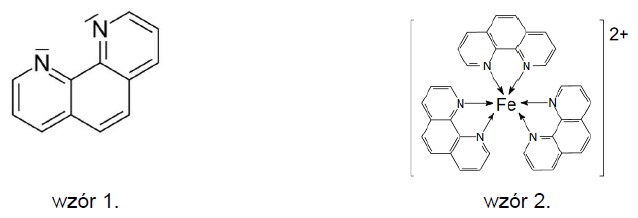
Wybór poprawnych określeń dotyczących agaru. Zadanie 49.3. Informator CKE chemia 2023 rozszerzony (2 punkty)
Agar to substancja żelująca wytwarzana z krasnorostów. W jej skład wchodzi m.in. agaroza – polisacharyd, który jest polimerem β-D-galaktozy i α-3,6-anhydro-L-galaktozy. Schemat struktury tego polisacharydu ilustruje rysunek:
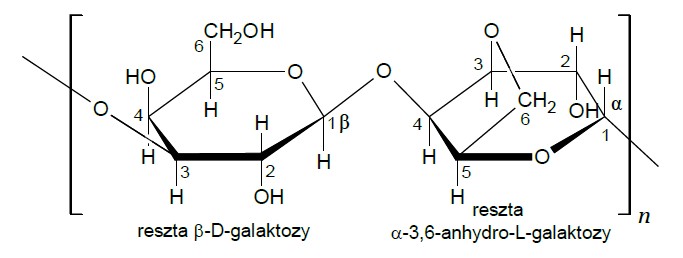
Uzupełnij poniższe zdania. Wybierz i zaznacz jedno określenie spośród podanych w każdym nawiasie. Agar dobrze rozpuszcza się w gorącej wodzie i tworzy (roztwór właściwy / układ koloidalny). Stygnąc, przyjmuje postać (zolu / żelu). Takie właściwości agaru są możliwe dzięki oddziaływaniu jego cząsteczek z cząsteczkami wody polegającym na tworzeniu licznych wiązań (jonowych / kowalencyjnych / wodorowych). Podobne właściwości wykazuje otrzymywana z kości i skór zwierząt rzeźnych żelatyna, która jest (białkiem / dekstryną / polisacharydem).
Wybór odpowiednich piktogramów dla kwasu azotowego(V). Zadanie 50. Informator CKE chemia 2023 rozszerzony (2 punkty)
Poniżej przedstawiono wybrane piktogramy stosowane do oznaczania niebezpiecznych substancji i mieszanin.
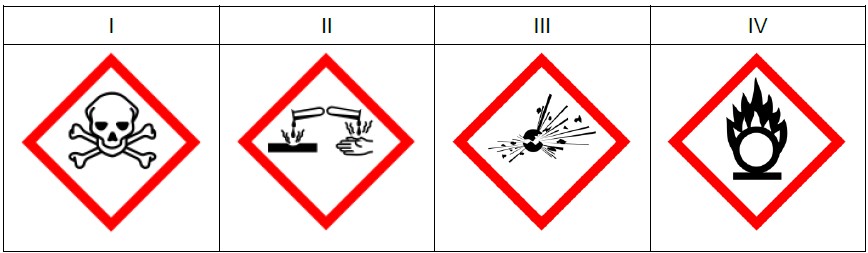
Spośród przedstawionych piktogramów wybierz dwa stosowane do opisu zagrożeń wynikających ze stosowania w laboratorium kwasu azotowego(V). Uzupełnij tabelę – wpisz oznaczenia cyfrowe wybranych piktogramów i zaznacz literę wskazującą znaczenie danego piktogramu.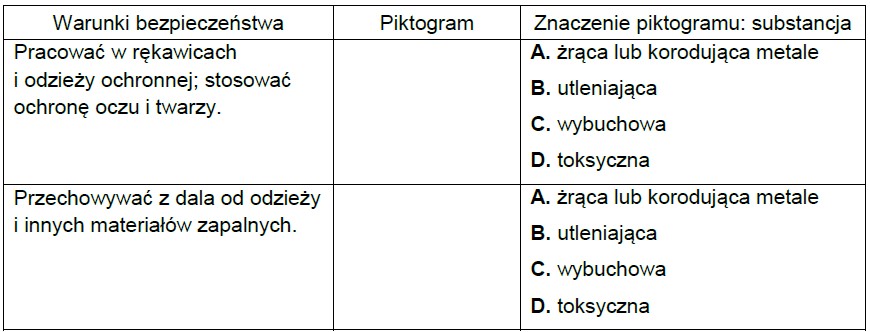
Obliczanie procentu wagowego diwodoroortofosforanu(V) wapnia w superfosfacie. Zadanie 51. Informator CKE chemia 2023 rozszerzony (2 punkty)
Superfosfat jest nawozem sztucznym zawierającym diwodoroortofosforan(V) wapnia (Ca(H2PO4)), siarczan(VI) wapnia (CaSO4) oraz zanieczyszczenia niezawierające wapnia i siarki. W superfosfacie zawartość procentowa siarki wynosi 11,9%, a zawartość procentowa wapnia jest równa 22,2%.
Oblicz w procentach masowych zawartość diwodoroortofosforanu(V) wapnia w superfosfacie.
Wskazanie nazwy zjawiska stanowiącego podstawę opisanego w treści zadania procesu. Zadanie 55. Informator CKE chemia 2023 rozszerzony (1 punkt)
Poniżej przedstawiono opis jednej z najnowocześniejszych, a jednocześnie powszechnie stosowanej metody pokrywania karoserii samochodowych powłokami antykorozyjnymi lub dekoracyjnymi.
Do malowania wykorzystuje się farby tworzące z wodą układy koloidalne. Malowanie zachodzi w wyniku przepływu prądu elektrycznego. W polu elektrycznym obdarzone ładunkiem elektrycznym koloidalne cząstki farby poruszają się do elektrody, którą jest karoseria samochodu. Proces nakładania powłoki prowadzi się z zastosowaniem prądu stałego o określonym napięciu.
Zaznacz nazwę zjawiska stanowiącego podstawę opisanego procesu.
A. elektroliza
B. elektroforeza
C. ekstrakcja
D. sedymentacja
Wybór polimeru, który będzie najłatwiej ulegał biodegradacji. Zadanie 56. Informator CKE chemia 2023 rozszerzony (1 punkt)
Wobec ciągle wzrastającej ilości odpadów, w których duży udział mają tworzywa sztuczne, coraz bardziej istotnym kryterium doboru i stosowania polimerów staje się ich zdolność do biodegradacji. Ten proces polega na rozkładzie makrocząsteczek pod wpływem mikroorganizmów takich jak drożdże lub bakterie. Produktami całkowitej biodegradacji są zwykle gazy, np. CO2, CH4, NH3 i para wodna.
Czynniki sprzyjające biodegradacji to niska masa cząsteczkowa polimeru, jego właściwości hydrofilowe oraz obecność grup funkcyjnych podatnych na enzymatyczną hydrolizę lub utlenianie.
Poniżej przedstawiono wzory trzech polimerów: dwa z nich powstają w wyniku procesów polimeryzacji, a jeden – w reakcji polikondensacji.
Wybierz spośród przedstawionych polimerów ten, który będzie najłatwiej ulegał biodegradacji, i napisz równanie reakcji jego otrzymywania z odpowiedniego monomeru.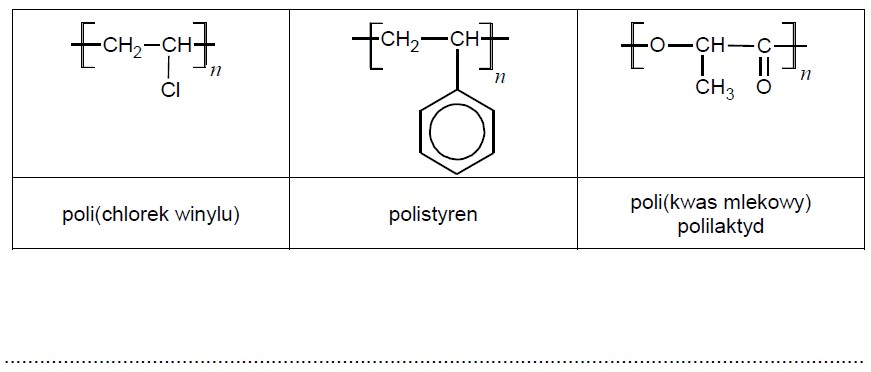
Zapis sumarycznego równania reakcji biegnącej w ogniwie paliwowym. Zadanie 57.1. Informator CKE chemia 2023 rozszerzony (1 punkt)
W pracującym ogniwie paliwowym zasilanym bezpośrednio metanolem na elektrodach biegną reakcje chemiczne:
reakcja 1: O2 (g) + 4H+ (aq) + 4ē → 2H2O (c)
reakcja 2: CH3OH (g) + H2O (c) → CO2 (g) + 6H+ (aq) + 6ē
Napisz sumaryczne równanie reakcji biegnącej w opisanym ogniwie paliwowym.
Wybór właściwych wyrażeń opisujących ogniwo paliwowe. Zadanie 57.2. Informator CKE chemia 2023 rozszerzony (1 punkt)
W pracującym ogniwie paliwowym zasilanym bezpośrednio metanolem na elektrodach biegną reakcje chemiczne:
reakcja 1: O2 (g) + 4H+ (aq) + 4ē → 2H2O (c)
reakcja 2: CH3OH (g) + H2O (c) → CO2 (g) + 6H+ (aq) + 6ē
Uzupełnij poniższe zdanie. Wybierz i zaznacz jedną odpowiedź spośród podanych w każdym nawiasie. W opisanym ogniwie paliwowym na katodzie biegnie reakcja (1 / 2), a na anodzie biegnie reakcja (1 / 2). W sumarycznym procesie bierze udział (4 / 6 / 12) moli elektronów w przeliczeniu na 1 mol reduktora.
Obliczanie efektu cieplnego sumarycznego procesu przebiegającego w ogniwie paliwowym. Zadanie 58. Informator CKE chemia 2023 rozszerzony (2 punkty)
W pracującym ogniwie paliwowym zasilanym bezpośrednio metanolem na elektrodach biegną reakcje chemiczne:
reakcja 1: O2 (g) + 4H+ (aq) + 4ē → 2H2O (c)
reakcja 2: CH3OH (g) + H2O (c) → CO2 (g) + 6H+ (aq) + 6ē
Oblicz efekt cieplny sumarycznego procesu przebiegającego w opisanym ogniwie paliwowym w przeliczeniu na 1 mol metanolu. Przyjmij, że w warunkach pracy ogniwa: ΔHtw. (CH3OH (g)) = – 201,0 kJ∙mol–1, ΔHtw. (H2O (c)) = – 285,8 kJ∙mol–1, ΔHtw. (CO2 (g)) = – 393,5 kJ∙mol–1.