Wskazanie ucznia, który poprawnie wykonał doświadczenie. Zadanie 23. Informator CKE chemia 2023 rozszerzony (2 punkty)
Uczniowie wykonywali doświadczenie, podczas którego działali kwasem solnym na węglan wapnia, w zestawie umożliwiającym pochłanianie wydzielającego się CO2 w roztworze KOH. Naczynie z tym roztworem miało być zważone przed doświadczeniem i po jego zakończeniu. Reakcje wydzielania i pochłaniania CO2 opisują równania:
CaCO3 + 2HCl → CaCl2 + H2O + CO2
CO2 + 2KOH → K2CO3 + H2O
Węglan wapnia był stosowany w nadmiarze, natomiast kwas solny miał nieznane stężenie, ale mógł zostać dokładnie odmierzony. Na podstawie jego objętości oraz przyrostu masy naczynia z KOH, uczniowie mieli oszacować stężenie roztworu HCl. Swoje pomiary zapisali w poniższej tabeli: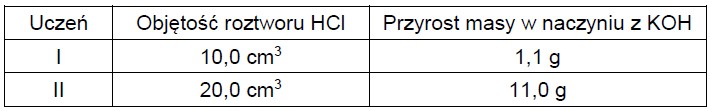
Okazało się, że jeden z uczniów błędnie zmierzył lub błędnie zapisał przyrost masy.
Oblicz stężenie molowe badanego roztworu na podstawie wyników ucznia I i ucznia II. Wskaż ucznia, który poprawnie wykonał doświadczenie. Odpowiedź uzasadnij. Doświadczenie poprawnie wykonał uczeń: Uzasadnienie:
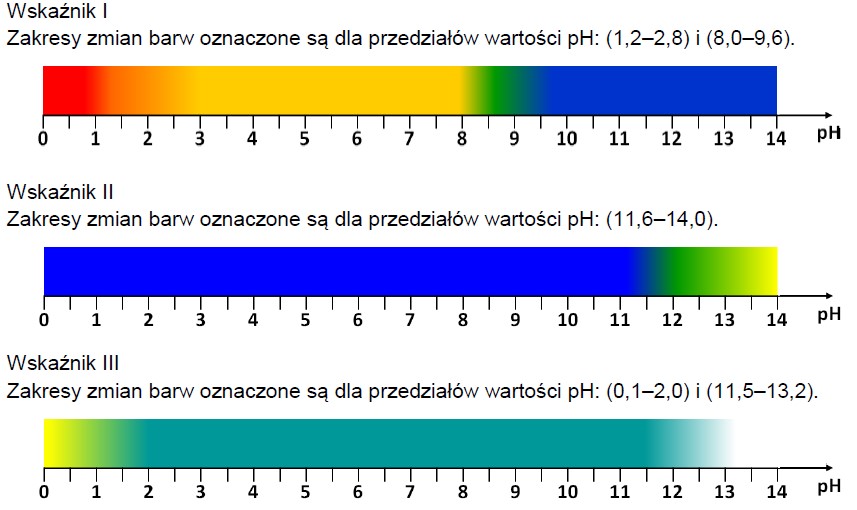
Uszeregowanie związków chemicznych według wzrastającego stężenia jonów wodorotlenkowych w ich roztworach. Zadanie 26.1. Informator CKE chemia 2023 rozszerzony (1 punkt)
Przygotowano wodne roztwory pięciu substancji chemicznych o podanych niżej wzorach. Wszystkie roztwory miały takie samo stężenie molowe 0,1 mol·dm–3.
NaCl CH3COOH Ba(OH)2 NaNO2 HBr
Uszereguj związki o podanych wzorach zgodnie ze wzrastającym stężeniem jonów OH– ich wodnych roztworów. Napisz wzory tych związków w odpowiedniej kolejności.
Wybór roztworów w których oranż metylowy zabarwi się na kolor czerwony. Zadanie 26.2. Informator CKE chemia 2023 rozszerzony (1 punkt)
Przygotowano wodne roztwory pięciu substancji chemicznych o podanych niżej wzorach. Wszystkie roztwory miały takie samo stężenie molowe 0,1 mol·dm–3.
NaCl CH3COOH Ba(OH)2 NaNO2 HBr
Napisz wzory tych związków, których wodne roztwory po dodaniu do nich wodnego roztworu oranżu metylowego zabarwią się na czerwono.
Obliczanie pH roztworu stanowiącego mieszaninę roztworów dwóch słabych kwasów. Zadanie 27. Informator CKE chemia 2023 rozszerzony (2 punkty)
W praktyce analitycznej stosuje się roztwory zawierające mieszaninę dwóch kwasów lub zasad. Jeżeli roztwór zawiera mieszaninę dwóch słabych kwasów jednoprotonowych, można przyjąć z pewnym przybliżeniem, że stężenie jonów hydroniowych w tym roztworze jest równe:
![]()
gdzie:
KaI i KaII – stałe dysocjacji kwasów
cI i cII – stężenia kwasów w otrzymanej mieszaninie.
Na podstawie: A. Hulanicki, Reakcje kwasów i zasad w chemii analitycznej, Warszawa 1992.
W temperaturze T zmieszano 50,0 cm3 wodnego roztworu kwasu metanowego (mrówkowego) o stężeniu 0,10 mol · dm–3 z 50,0 cm3 wodnego roztworu kwasu etanowego (octowego) o stężeniu 0,10 mol · dm–3. W temperaturze T stała dysocjacji kwasu metanowego jest równa 1,77 · 10–4, a stała dysocjacji kwasu etanowego wynosi 1,75 · 10–5.
Na podstawie: R. Morrison, R. Boyd, Chemia organiczna, Warszawa 1985.
Oblicz pH otrzymanego roztworu. W obliczeniach przyjmij, że objętość powstałego roztworu jest sumą objętości roztworów wyjściowych. Wynik końcowy zaokrąglij do pierwszego miejsca po przecinku.
Wskazanie wzorów związków chemicznych których roztwory po zmieszaniu utworzą roztwór buforowy. Zadanie 28.1. Informator CKE chemia 2023 rozszerzony (1 punkt)
Roztwory zawierające porównywalne liczby drobin kwasu Brønsteda i sprzężonej z nim zasady nazywane są roztworami buforowymi. Przykładem buforu może być mieszanina roztworu octanu sodu i roztworu kwasu octowego. W takim roztworze ustala się równowaga chemiczna:
HA + H2O ⇄ H3O+ + A–
opisywana przez stałą dysocjacji kwasu HA.
Ponieważ
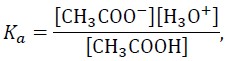
to pH buforu octanowego można z pewnym przybliżeniem obliczyć ze wzoru:
![]()
Wartość pH buforu prawie nie zależy od jego stężenia i nieznacznie się zmienia podczas dodawania niewielkich ilości mocnych kwasów lub mocnych zasad.
Zaznacz wzory dwóch związków chemicznych, których roztwory po zmieszaniu w odpowiednim stosunku pozwolą uzyskać roztwór buforowy.
HCl NaOH NH4Cl NaCl
Obliczanie pH roztworu buforowego. Zadanie 28.2. Informator CKE chemia 2023 rozszerzony (2 punkty)
Roztwory zawierające porównywalne liczby drobin kwasu Brønsteda i sprzężonej z nim zasady nazywane są roztworami buforowymi. Przykładem buforu może być mieszanina roztworu octanu sodu i roztworu kwasu octowego. W takim roztworze ustala się równowaga chemiczna:
HA + H2O ⇄ H3O+ + A–
opisywana przez stałą dysocjacji kwasu HA.
Ponieważ
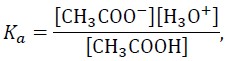
to pH buforu octanowego można z pewnym przybliżeniem obliczyć ze wzoru:
![]()
Wartość pH buforu prawie nie zależy od jego stężenia i nieznacznie się zmienia podczas dodawania niewielkich ilości mocnych kwasów lub mocnych zasad.
Zmieszano 100 cm3 roztworu octanu sodu o stężeniu 0,875 mol∙dm–3 i 400 cm3 roztworu kwasu octowego o stężeniu 0,125 mol∙dm–3. Uzyskano 500 cm3 roztworu w temperaturze 298 K.
Oblicz pH uzyskanego roztworu buforowego.
Obliczanie iloczynu rozpuszczalności wodorotlenku wapnia. Zadanie 29. Informator CKE chemia 2023 rozszerzony (2 punkty)
W kolbie umieszczono 1,0 g tlenku wapnia, dodano 100 cm3 wody, wymieszano i kolbę zamkniętą korkiem pozostawiono na kilka godzin. Następnie pobrano trochę roztworu i w temperaturze 25 °C zmierzono jego pH. Po pewnym czasie pomiar powtórzono, ale wartość pH nie zmieniła się i wynosiła 12,33. Przyjęto, że cały tlenek wapnia przereagował zgodnie z równaniem:
CaO + H2O → Ca(OH)2
i ustaliła się równowaga między fazą stałą a roztworem:
Ca(OH)2 (s) ⇄ Ca2+(aq) + 2OH–(aq)
Oblicz wartość iloczynu rozpuszczalności (Ks) wodorotlenku wapnia w warunkach doświadczenia.
Rysowanie wykresu zależności pK wody ciężkiej od temperatury. Zadanie 30. Informator CKE chemia 2023 rozszerzony (4 punkty)
Woda ciężka (tlenek deuteru, D2O), której cząsteczki zawierają deuter – izotop wodoru 2H, podobnie jak zwykła woda, ulega odwracalnemu procesowi autodysocjacji opisanemu równaniem:
2D2O ⇄ D3O+ + OD–.
Proces autodysocjacji można opisać stałą dysocjacji KD2O zależną od temperatury. Wygodnym sposobem posługiwania się stałą dysocjacji jest wyrażenie jej wartości w formie zlogarytmowanej: pKD2O= − logKD2O.
Zestawienie wartości pKD2O w różnych temperaturach podano w tabeli.
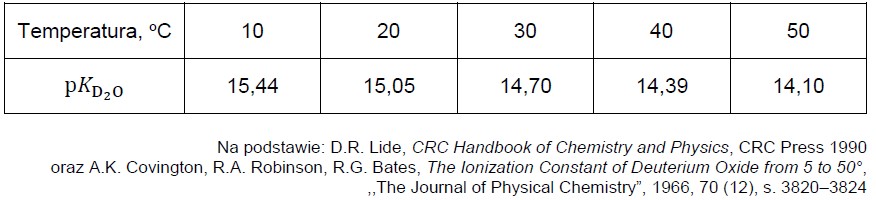
Wartość pKH2O (pKw) dla procesu autodysocjacji wody zwykłej w temperaturze 25 oC wynosi 14,00.
Narysuj wykres zależności pKD2O od temperatury i oblicz stężenie molowe jonów OD– w ciężkiej wodzie w temperaturze 25 oC. Rozstrzygnij, który proces dysocjacji – D2O czy H2O – zachodzi w większym stopniu w temperaturze 25 oC. 
Ocena poprawności zdań dotyczących ogniw chemicznych i półogniw. Zadanie 31. Informator CKE chemia 2023 rozszerzony (1 punkt)
Oceń prawdziwość poniższych zdań. Zaznacz P, jeśli zdanie jest prawdziwe, albo F – jeśli jest fałszywe. 1. W ogniwie opisanym schematem: Fe | Fe2+ || Ag+ | Ag funkcję katody pełni półogniwo żelazne, a funkcję anody – półogniwo srebrowe. 2. W pracującym ogniwie opisanym schematem: Zn | Zn2+ || Cu2+ | Cu na katodzie przebiega reakcja opisana równaniem Cu2+ + 2ē → Cu. 3. Podczas pracy ogniwa zbudowanego z półogniwa magnezowego i półogniwa ołowiowego następuje roztwarzanie magnezu i wydzielanie się ołowiu.
Obliczanie wartości SEM w określonym ogniwie chemicznym. Zadanie 32.1. Informator CKE chemia 2023 rozszerzony (1 punkt)
W półogniwach A i B zachodzą reakcje opisane równaniami:
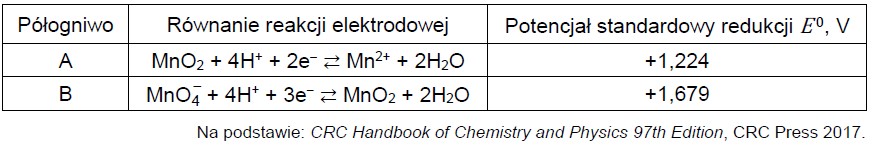
Zbudowano ogniwo z półogniw A i B.
Oblicz siłę elektromotoryczną (SEM) ogniwa zbudowanego z półogniwa A i półogniwa B w warunkach standardowych.
Zapis równania chemicznego procesu przebiegającego w ogniwie chemicznym. Zadanie 32.2. Informator CKE chemia 2023 rozszerzony (1 punkt)
W półogniwach A i B zachodzą reakcje opisane równaniami:

Zbudowano ogniwo z półogniw A i B.
Napisz w formie jonowej skróconej sumaryczne równanie reakcji zachodzącej w ogniwie zbudowanym z półogniw A i B.