Zadanie 8.2. Zapis podpowłokowej konfiguracji elektronowej jonu. Doświadczenia chemiczne w zadaniach część 1. Rozdział 4.1 (1 punkt)
Fotografia 1. ilustruje pewien związek chemiczny X zawierający około 26,5% masowych potasu oraz tlen i pierwiastek bloku d. W stanie podstawowym atomu tego pierwiastka wszystkie elektrony walencyjne są niesparowane. Opisaną substancję wprowadzono do zlewki zawierającej wodę destylowaną i całkowicie rozpuszczono. Z uzyskanej mieszaniny pobrano następnie po 2 ml próbek i umieszczono w trzech probówkach. Do naczyń tych w sposób losowy oraz w nadmiarze wprowadzono roztwory – KOH, H2SO4 oraz wodę destylowaną. Efekt końcowy tego doświadczenia przedstawiają fotografie 2.–4.

Do zawartości jednej z probówek widocznych na fotografiach 2.–4. wprowadzono wodny roztwór pewnego związku chemicznego. Standardowy potencjał redukcji półogniwa, w którym związek ten stanowi formę zredukowaną wynosi 0,695 V. Zamieszczona poniżej fotografia została wykonana w trakcie przebiegu opisanej reakcji chemicznej.

Napisz stosując symbole podpowłok pełną konfigurację elektronową powstającego jonu, którego obecność przyczynia się do zmiany zabarwienia roztworu na widoczny kolor. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zadanie 9.1. Wskazanie właściwej fotografii oraz zapis wzoru sumarycznego związku chemicznego. Doświadczenia chemiczne w zadaniach część 1. Rozdział 4.1 (1 punkt)
Przeprowadzono doświadczenie chemiczne według schematu:

Fotografia 1. przedstawia tlenek chromu(III). Zawartość probówki 2. stanowi klarowny roztwór, w którym występują jony kompleksowe o liczbie koordynacyjnej 6, natomiast w probówce 3. znajduje się zawiesina pewnego związku chromu.
Jeśli do zalkalizowanej zawartości probówki 2. wprowadzony zostanie nadtlenek wodoru, wówczas powstanie roztwór zawierający związek chemiczny, którego krystaliczną postać przedstawia jedna z fotografii:

Wskaż fotografię (A, B lub C) przedstawiającą związek chemiczny, którego roztwór uzyskano w wyniku przebiegu opisanej reakcji chemicznej. Napisz jego wzór sumaryczny. Wybrana fotografia: Wzór sumaryczny: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zadanie 9.2. Zapis równania reakcji chemicznej. Doświadczenia chemiczne w zadaniach część 1. Rozdział 4.1 (2 punkty)
Przeprowadzono doświadczenie chemiczne według schematu:

Fotografia 1. przedstawia tlenek chromu(III). Zawartość probówki 2. stanowi klarowny roztwór, w którym występują jony kompleksowe o liczbie koordynacyjnej 6, natomiast w probówce 3. znajduje się zawiesina pewnego związku chromu.
Jeśli do zalkalizowanej zawartości probówki 2. wprowadzony zostanie nadtlenek wodoru, wówczas powstanie roztwór zawierający związek chemiczny, którego krystaliczną postać przedstawia jedna z fotografii:

Napisz w formie jonowej skróconej równanie reakcji chemicznej jaka przebiegła. Współczynniki stechiometryczne uzgodnij metodą bilansu jonowo-elektronowego. Proces utleniania: Proces redukcji: Równanie sumaryczne: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zadanie 10. Wskazanie właściwej fotografii oraz zapis równania reakcji chemicznej. Doświadczenia chemiczne w zadaniach część 1. Rozdział 4.1 (1 punkt)
Przeprowadzono doświadczenie chemiczne według schematu:

Fotografia 1. przedstawia tlenek chromu(III). Zawartość probówki 2. stanowi klarowny roztwór, w którym występują jony kompleksowe o liczbie koordynacyjnej 6, natomiast w probówce 3. znajduje się zawiesina pewnego związku chromu.
Związek przedstawiony na 1. fotografii wprowadzono do niewielkiego nadmiaru roztworu kwasu siarkowego(VI). Uzyskano wówczas mieszaninę przedstawioną na jednaj z fotografii (A, B, C lub D).

Wskaż oznaczenie literowe właściwej fotografii. Odpowiedź uzasadnij równaniem reakcji chemicznej zapisanym w formie jonowej skróconej. Wybrana fotografia: Równanie reakcji: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zadanie 11. Zapis równania reakcji chemicznej oraz wyjaśnienie dlaczego nie jest to reakcja redoks. Doświadczenia chemiczne w zadaniach część 1. Rozdział 4.1 (2 punkty)
Przeprowadzono doświadczenie chemiczne według schematu:

Fotografia 1. przedstawia tlenek chromu(III). Zawartość probówki 2. stanowi klarowny roztwór, w którym występują jony kompleksowe o liczbie koordynacyjnej 6, natomiast w probówce 3. znajduje się zawiesina pewnego związku chromu.
Napisz w formie jonowej skróconej równanie reakcji chemicznej, której przebieg doprowadził do uzyskania zawartości widocznej na 3. fotografii. Wyjaśnij, dlaczego opisanej przemiany nie można nazwać reakcją redoks. Równanie reakcji: Wyjaśnienie: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zadanie 12. Zapis wzorów sumarycznych związków chemicznych. Doświadczenia chemiczne w zadaniach część 1. Rozdział 4.1 (1 punkt)
Przeprowadzono doświadczenie chemiczne według schematu:
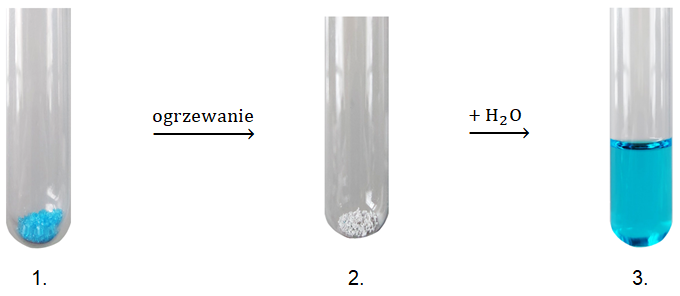
Substancja znajdująca się w 1. probówce jest pięciowodnym hydratem pochodzącym od mocnego, dwuprotonowego kwasu i zawiera 25,6% masowych kationów X2+. Związek chemiczny w 2. probówce jest solą bezwodną, zawierającą 40% masowych takich samych kationów metalu co hydrat. Konfiguracja elektronowa drobin X2+ w stanie podstawowym może być przedstawiona w postaci [Ar] 3d9.
Napisz wzory sumaryczne ciał stałych znajdujących się w probówkach 1. oraz 2. 1.: 2.: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zadanie 13. Zapis wzoru sumarycznego akwakompleksu. Doświadczenia chemiczne w zadaniach część 1. Rozdział 4.1 (1 punkt)
Przeprowadzono doświadczenie chemiczne według schematu:

Substancja znajdująca się w 1. probówce jest pięciowodnym hydratem pochodzącym od mocnego, dwuprotonowego kwasu i zawiera 25,6% masowych kationów X2+. Związek chemiczny w 2. probówce jest solą bezwodną, zawierającą 40% masowych takich samych kationów metalu co hydrat. Konfiguracja elektronowa drobin X2+ w stanie podstawowym może być przedstawiona w postaci [Ar] 3d9.
Roztwór w probówce 3. zawdzięcza swą barwę obecności jonów kompleksowych o liczbie koordynacyjnej 6, w których jonem centralnym są drobiny X2+, a cząsteczki wody – ligandami.
Napisz wzór sumaryczny opisanych akwakompleksów. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zadanie 14.1. Zapis wzorów sumarycznych substancji. Doświadczenia chemiczne w zadaniach część 1. Rozdział 4.1 (1 punkt)
Przeprowadzono doświadczenie chemiczne według schematu:

Substancja znajdująca się w 1. probówce jest pięciowodnym hydratem pochodzącym od mocnego, dwuprotonowego kwasu i zawiera 25,6% masowych kationów X2+. Związek chemiczny w 2. probówce jest solą bezwodną, zawierającą 40% masowych takich samych kationów metalu co hydrat. Konfiguracja elektronowa drobin X2+ w stanie podstawowym może być przedstawiona w postaci [Ar] 3d9.
Przeprowadzono dwuetapowe doświadczenie chemiczne.
Etap I.: do zawartości probówki 3. wprowadzono zasadę sodową.
Etap II.: uzyskaną mieszaninę poreakcyjną ogrzano w płomieniu palnika gazowego. Fotografie A oraz B przedstawiają zawartość naczyń po wykonaniu opisanych czynności.

Napisz wzory sumaryczne substancji chemicznych stanowiących widoczne na fotografiach A oraz B osady. A: B: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zadanie 15. Zapis równania reakcji chemicznej. Doświadczenia chemiczne w zadaniach część 1. Rozdział 4.1 (1 punkt)
Do wodnego roztworu azotanu(V) srebra wprowadzono wodny roztwór pewnego związku chemicznego spośród
CuSO4, NH3, NaCl, KMnO4.
Uzyskano wówczas mieszaninę widoczną na zamieszczonej fotografii.

Napisz w formie jonowej skróconej równanie reakcji chemicznej, której przebieg doprowadził do powstania widocznej mieszaniny. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zadanie 16.1. Zapis równania reakcji tworzenia tlenku. Doświadczenia chemiczne w zadaniach część 1. Rozdział 4.1 (1 punkt)
Poniższy schemat ilustruje ciąg przemian jakie można wykonać, w celu otrzymania odczynnika Tollensa – roztworu o odczynie zasadowym, zawierającego między innymi jony kompleksowe o liczbie koordynacyjnej 2, w których jonem centralnym jest kation srebra(I), a ligandami cząsteczki amoniaku.

Postępując według opisanego schematu, w pierwszym etapie doświadczenia powstaje tlenek X, w którym srebro ma taki sam stopień utlenienia jak w wyjściowym substracie reakcji.
Napisz w formie jonowej skróconej równanie reakcji chemicznej przebiegającej w 1. etapie, jeśli jako drugi z substratów zastosowano zasadę sodową. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zadanie 16.2. Zapis równania reakcji z udziałem wody amoniakalnej. Doświadczenia chemiczne w zadaniach część 1. Rozdział 4.1 (1 punkt)
Poniższy schemat ilustruje ciąg przemian jakie można wykonać, w celu otrzymania odczynnika Tollensa – roztworu o odczynie zasadowym, zawierającego między innymi jony kompleksowe o liczbie koordynacyjnej 2, w których jonem centralnym jest kation srebra(I), a ligandami cząsteczki amoniaku.

Postępując według opisanego schematu, w pierwszym etapie doświadczenia powstaje tlenek X, w którym srebro ma taki sam stopień utlenienia jak w wyjściowym substracie reakcji.
Napisz jonowe równanie reakcji chemicznej przebiegającej w 2. etapie doświadczenia, w którym bierze udział woda amoniakalna. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone



