Obliczanie stężenia molowego jonów w wodnym roztworze soli w którym przebiega hydroliza anionowa (hydroliza soli)
Rozważając równowagi jonowe w wodnych roztworach soli słabych kwasów i mocnych zasad lub mocnych kwasów i słabych zasad istnieje relacja: Ka·Kb = Kw. W przypadku roztworu zawierającego sól pochodzącą od słabego kwasu i mocnej zasady, wielkość Ka jest wówczas stałą równowagi dysocjacji kwasu Brønsteda, natomiast Kb to stała równowagi reakcji hydrolizy sprzężonej z nim zasady Brønsteda. Stała równowagi autodysocjacji wody (Kw) w temperaturze 25 ⁰C ma wartość około 10–14.
Na podstawie: P. W. Atkins, Chemia fizyczna, Warszawa 2012.
W kolbie miarowej o pojemności 500 cm3, w temperaturze 25 OC znajdował się roztwór octanu sodu o pH = 9 i nieznanym stężeniu molowym.
Oblicz stężenie znajdujących się w nim kationów sodu. Wynik podaj w mg·ml–1 z dokładnością do trzech cyfr znaczących. Rozwiązanie tego zadania dostępne jest nieodpłatnie pod poniższym linkiem: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zapis równania odpowiedniej reakcji chemicznej oraz wskazanie nazwy drobiny
W wyniku nasycania wody amoniakiem uzyskuje się roztwór zwany wodą amoniakalną. W celu przygotowania opisanego roztworu, odmierzono pewną objętość amoniaku, a następnie wprowadzono do naczynia zawierającego wodę destylowaną, uzyskując roztwór wody amoniakalnej o stężeniu równym 0,5 mol∙dm–3. Zanurzony w wodzie amoniakalnej żółty papierek wskaźnikowy zmienia swoją barwę.
Napisz w formie jonowej skróconej równanie procesu, w wyniku którego powstają drobiny, jakich obecność przyczynia się do zmiany zabarwienia papierka wskaźnikowego, a następnie podaj nazwę tych drobin. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie minimalnej wartości pH roztworu sprzyjającej strąceniu osadu wodorotlenku wapnia (iloczyn rozpuszczalności)
W pewnej temperaturze rozpuszczalność wodorotlenku wapnia wynosi około 90 mg na 100 g wody.
Oblicz, przy jakiej minimalnej wartości pH w opisanych warunkach strąca się osad tego wodorotlenku? Wynik podaj z dokładnością do trzech cyfr znaczących. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Wskazanie wzorów kwasów oraz zasad Lewisa wśród substratów czterech reakcji chemicznych
Zgodnie z elektronową teorią kwasów i zasad Lewisa, kwasem jest drobina zdolna do przyłączenia pary elektronowej, a zasadą jest wówczas donor takiej pary.
W tabeli poniżej przedstawiono równania kilku reakcji chemicznych.
W puste pola wpisz wzory tych cząsteczek lub jonów stanowiących substraty opisanych przemian, które pełnią w nich rolę kwasów i zasad w teorii Lewisa. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone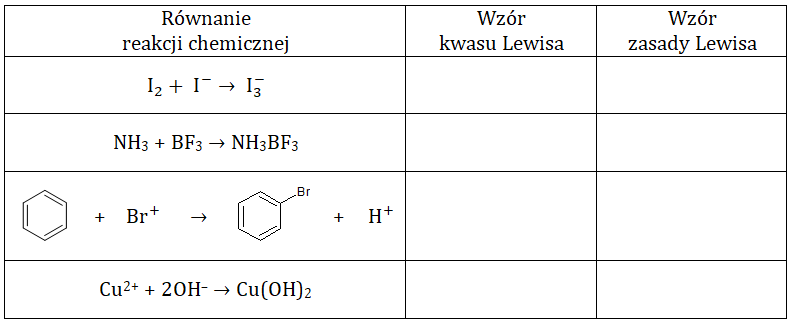
Zapis równania reakcji anionu tlenkowego z wodą z zapisem elektronowych wzorów drobin
Zgodnie z elektronową teorią kwasów i zasad Lewisa, kwasem jest drobina zdolna do przyłączenia pary elektronowej, a zasadą jest wówczas donor takiej pary.
Na skutek reakcji biegnącej między cząsteczką wody a anionem tlenkowym, podczas działania wodą na tlenek litowca dochodzi do zniszczenia sieci krystalicznej tlenku.
Stosując wzory elektronowe odpowiednich cząsteczek oraz jonów napisz równanie opisanej reakcji chemicznej. Wskaż wzór sumaryczny drobiny, która pełnij w tej przemianie rolę kwasu oraz drobiny będącej zasadą Lewisa. Równanie reakcji: Kwas Lewisa: Zasada Lewisa: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
