Objętość roztworu kwasu azotowego(V) niezbędna do reakcji z mieszaniną węglanów
Na minerał zawierający po 0,1 mola każdego z węglanów: baru, srebra oraz wapnia podziałano stechiometryczną ilością stężonego roztworu kwasu azotowego(V). Zawartość naczynia ogrzewano, a po ochłodzeniu uzupełniono wodą do wyjściowej objętości roztworu.
Oblicz, jaka minimalna objętość (cm3) 63% roztworu kwasu azotowego(V) o gęstości 1,38 g·cm–3 powinna zostać użyta, w celu całkowitego przereagowania ze składnikami minerału o podanym w informacji wstępnej składzie? Wynik podaj z dokładnością do pierwszego miejsca po przecinku. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie objętości roztworu kwasu niezbędnej do zobojętnienia roztworu stanowiącego mieszaninę substancji
W pewnej objętości wody destylowanej rozpuszczono próbkę wodorotlenku sodu, w której zanieczyszczenia w postaci węglanu sodu stanowiły 4% masy. W ten sposób uzyskano 200 g roztworu o zawartości wodorotlenku sodu równej 12% wagowych.
Oblicz objętość 16% roztworu kwasu solnego o gęstości 1,07 g/cm3 niezbędną do zobojętnienia przygotowanego roztworu, który opisano w informacji wprowadzającej. Wynik obliczeń podaj w centymetrach sześciennych, z dokładnością do cyfry jedności. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie ilości substancji stałej oraz rozpuszczalnika, jakie trzeba zmieszać w celu uzyskania roztworu o określonym stężeniu
W pewnej objętości wody destylowanej rozpuszczono próbkę wodorotlenku sodu, w której zanieczyszczenia w postaci węglanu sodu stanowiły 4% masy. W ten sposób uzyskano 200 g roztworu o zawartości wodorotlenku sodu równej 12% wagowych.
Oblicz objętość wody destylowanej (d = 1 g/cm3) oraz masę próbki użytej do przygotowania roztworu o podanej w informacji wprowadzającej zawartości wodorotlenku. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie stężenia procentowego roztworu kwasu mlekowego powstałego w wyniku fermentacji laktozy (wydajność reakcji)
Mleko jest układem stanowiącym mieszaninę różnych substancji chemicznych, a jego gęstość wynosi zwykle 1,03 g/cm3. Za nieco słodki smak odpowiada obecność znajdującej się w nim laktozy – dwucukru o wzorze sumarycznym C12H22O11, który w mleku krowim stanowi około 4,6% masy. W sprzyjających warunkach, w obecności odpowiednich bakterii laktoza zostaje przekształcona w kwas mlekowy:
C12H22O11 + H2O ⟶ 4C3H6O3
Oblicz stężenie procentowe kwasu mlekowego w kwaśnym mleku uzyskanym w wyniku fermentacji laktozy zawartej w 1 litrze mleka krowiego, jeśli wydajność tego procesu wynosi 65%. Wynik podaj z dokładnością do trzech cyfr znaczących. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie stężenia molowego etanolu w roztworze powstałym w wyniku fermentacji alkoholowej glukozy
Jednym z płynów infuzyjnych jest wodny roztwór glukozy o stężeniu 50 mg·ml–1, dostępny w butelkach o pojemności 0,5 dm3. W sprzyjających warunkach cukier ten ulega fermentacji alkoholowej zgodnie z równaniem:
C6H12O6 ⟶ 2C2H5OH + 2CO2↑
Oblicz, jakie stężenie molowe mógłby osiągnąć powstały w wyniku fermentacji glukozy roztwór etanolu, jeśli wydajność takiego procesu wyniosłaby 36%? Przyjmij, że w trakcie procesu objętość roztworu praktycznie nie ulega zmianom. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie stężenia procentowego produktu reakcji roztworów kwasu siarkowego(VI) i wodorotlenku sodu
100 ml roztworu kwasu siarkowego(VI) o stężeniu 30% i gęstości 1,22 g·cm–3 poddano reakcji z taką ilością 10-procentowego roztworu wodorotlenku sodu, że nastąpiło całkowite zobojętnienie kwasu.
Oblicz stężenie procentowe powstałego roztworu soli. Wynik podaj z dokładnością do trzech cyfr znaczących. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Wyjaśnienie przyczyny większej rozpuszczalności w wodzie amoniaku, niż dwutlenku węgla (rozpuszczalność substancji)
W tabeli zebrano dane na temat rozpuszczalności w wodzie amoniaku i tlenku węgla(IV) pod ciśnieniem równym 1013 hPa w różnych temperaturach.
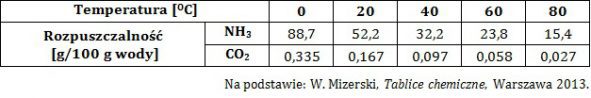
Wyjaśnij, dlaczego jeden z wymienionych gazów jest lepiej rozpuszczalny w wodzie od drugiego z nich? © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Ocena poprawności zdań dotyczących rozpuszczalności tlenku węgla(IV) oraz amoniaku (rozpuszczalność substancji)
W tabeli zebrano dane na temat rozpuszczalności w wodzie amoniaku i tlenku węgla(IV) pod ciśnieniem równym 1013 hPa w różnych temperaturach.

Oceń poprawność poniższych zdań dotyczących rozpuszczalności amoniaku oraz tlenku węgla(IV) wpisując literę „P” (prawda) lub literę „F” (fałsz). 1. W warunkach normalnych równe objętości obu gazów mają taką samą rozpuszczalność. 2. W roztworze o odczynie zasadowym możliwe będzie rozpuszczenie jeszcze większej ilości tlenku węgla(IV), natomiast rozpuszczalność amoniaku będzie mniejsza. 3. Niższa temperatura wody sprzyja rozpuszczaniu w niej obu gazów. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Przeliczanie rozpuszczalności siarczanu(VI) amonu z masy na liczbę moli w jednostce objętości wody
W temperaturze 20 oC rozpuszczalność siarczanu(VI) amonu ma wartość 75,2 g/100 g wody.
Oblicz z dokładnością do pierwszego miejsca po przecinku, ile moli tej soli można rozpuścić w 1 dm3 wody w opisanych warunkach? © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie rozpuszczalności siarczanu(VI) potasu na podstawie podanej masy wody oraz soli (rozpuszczalność substancji)
Do 80 g wody destylowanej wprowadzono 8,8 g bezwodnego siarczanu(VI) potasu. Zawartość naczynia dokładnie wymieszano uzyskując nasycony w temperaturze 20 oC roztwór soli.
Oblicz rozpuszczalność siarczanu(VI) potasu w podanych warunkach. Wynik wyraź w gramach na 100 g wody z dokładnością do cyfry jedności. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie rozpuszczalności dwuchromianu(VI) potasu na podstawie masy roztworu oraz substancji rozpuszczonej (rozpuszczalność substancji)
Nasycony w temperaturze 20 oC roztwór dwuchromianu(VI) potasu ma masę 56,1 g i zawiera 6,1 g substancji rozpuszczonej.
Oblicz z dokładnością do trzech cyfr znaczących rozpuszczalność (g/100 g wody) dwuchromianu(VI) potasu w podanej temperaturze. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie masy wody w podanej masie nasyconego roztworu mocznika (rozpuszczalność substancji)
W temperaturze 20 oC rozpuszczalność mocznika wynosi 108 g/100 g wody destylowanej.
Oblicz, jaką masę wody zawierają 52 g nasyconego w podanej temperaturze wodnego roztworu mocznika? © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone

