Obliczanie stężenia procentowego roztworu chlorku potasu izotonicznego z roztworem soli fizjologicznej
Roztwór soli fizjologicznej o zawartości 0,9% masowych chlorku sodu jest izotoniczny z osoczem krwi. Aby wykazywać tę cechę, każdy roztwór musi mieć identyczne sumaryczne stężenie molowe wszystkich indywiduów chemicznych (cząsteczek/jonów), niezdolnych do przechodzenia przez błonę półprzepuszczalną, przez którą kontaktuje się z innym roztworem.
Na podstawie: B. Filipowicz, W. Więckowski, Biochemia, Warszawa 1976.
Oblicz stężenie procentowe roztworu chlorku potasu izotonicznego z 0,9-procentowym roztworem chlorku sodu. Wynik podaj z dokładnością do trzech cyfr znaczących. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie stężenia procentowego glukozy w roztworze z jedną dawką leku Gastrolit
Gastrolit® jest lekiem stosowanym w celu zapobiegania oraz leczeniu odwodnienia w przebiegu biegunek. Jedna dawka Gastrolitu® stanowi mieszaninę zawierającą 350 mg chlorku sodu, 300 mg chlorku potasu, 500 mg wodorowęglanu sodu, 2,98 g glukozy oraz 20 mg rozpuszczalnego w wodzie wyciągu z rumianku, niezawierającego związków jonowych.
Na podstawie: ulotka leku Gastrolit®, Teva Pharmaceuticals Polska Sp. z o.o.
Oblicz stężenie procentowe glukozy w roztworze uzyskanym po rozpuszczeniu jednej dawki leku Gastrolit® w 300 g wody destylowanej. Wynik podaj z dokładnością do drugiego miejsca po przecinku. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie stężenia molowego jonów chlorkowych w roztworze z jedną dawką leku Gastrolit
Gastrolit® jest lekiem stosowanym w celu zapobiegania oraz leczeniu odwodnienia w przebiegu biegunek. Jedna dawka Gastrolitu® stanowi mieszaninę zawierającą 350 mg chlorku sodu, 300 mg chlorku potasu, 500 mg wodorowęglanu sodu, 2,98 g glukozy oraz 20 mg rozpuszczalnego w wodzie wyciągu z rumianku, niezawierającego związków jonowych.
Na podstawie: ulotka leku Gastrolit®, Teva Pharmaceuticals Polska Sp. z o.o.
Jedną dawkę leku Gastrolit® rozpuszczono w 250 ml wody destylowanej.
Oblicz stężenie molowe jonów chlorkowych znajdujących się w 200 ml roztworu, jeśli do jego sporządzenia wykorzystano jedną dawkę leku Gastrolit®. Wynik obliczeń podaj w mmol·dm–3, z dokładnością do cyfry jedności. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie stężenia masowego kationów w wodnym roztworze soli sodowej fluoresceiny
Stężenie masowe definiuje się jako masę substancji rozpuszczonej, jaka przypada na określoną jednostkę objętości roztworu.
Na podstawie: D. Mickiewicz, Podstawy obliczeń chemicznych. Część pierwsza, Łódź 2019.
Przez kanalik układu mikroprzepływowego przepływa wodny roztwór soli sodowej fluoresceiny (M = 376 g/mol) o stężeniu masowym równym 0,001 mg∙ml-1. Schemat struktury opisanego związku chemicznego przedstawia rysunek poniżej.
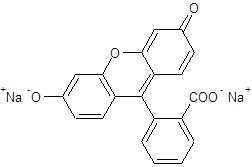
Oblicz stężenie kationów sodu w roztworze opisanym w informacji wprowadzającej. Wynik podaj w ng∙ml-1 (nanogramach na mililitr) z dokładnością do cyfry jedności. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie stężenia molowego kationów w wodnym roztworze soli sodowej fluoresceiny
Stężenie masowe definiuje się jako masę substancji rozpuszczonej, jaka przypada na określoną jednostkę objętości roztworu.
Na podstawie: D. Mickiewicz, Podstawy obliczeń chemicznych. Część pierwsza, Łódź 2019.
Przez kanalik układu mikroprzepływowego przepływa wodny roztwór soli sodowej fluoresceiny (M = 376 g/mol) o stężeniu masowym równym 0,001 mg∙ml-1. Schemat struktury opisanego związku chemicznego przedstawia rysunek poniżej.

Oblicz stężenie molowe kationów sodu w roztworze opisanym w informacji wprowadzającej. Wynik podaj w μmol∙dm-3 (mikromolach na decymetr sześcienny) z dokładnością do trzech cyfr znaczących. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Sporządzanie roztworu siarczanu(VI) cynku na drodze rozpuszczania w wodzie jego hydratu (hydraty)
W stałym stanie skupienia liczne związki chemiczne tworzą sole uwodnione zwane hydratami.
Oblicz, jaką masę hydratu siarczanu(VI) cynku-woda (1/7) należy rozpuścić w 200 g wody, aby uzyskać 5% roztwór ZnSO4? Wynik podaj z dokładnością do trzech cyfr znaczących. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Sporządzanie roztworu chlorku magnezu na drodze rozpuszczania w wodzie jego hydratu (hydraty)
W stałym stanie skupienia liczne związki chemiczne tworzą sole uwodnione zwane hydratami.
Oblicz, jaką ilość hydratu chlorku magnezu-woda (1/6) należy rozpuścić w 200 dm³ wody destylowanej, aby w uzyskanym w ten sposób roztworze stężenie jonów magnezowych było równe 0,6%? Dla uproszczenia obliczeń przyjmij gęstość wody równą 1 g/cm³. Wynik podaj w gramach, stosując przybliżenie do cyfry jedności. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie zawartości procentowej jonów w wodnym roztworze składającym się z wodorotlenku sodu oraz węglanu sodu
W pewnej objętości wody destylowanej rozpuszczono próbkę wodorotlenku sodu, w której zanieczyszczenia w postaci węglanu sodu stanowiły 4% masy. W ten sposób uzyskano 200 g roztworu o zawartości wodorotlenku sodu równej 12% wagowych.
Oblicz, wyrażoną w procentach wagowych zawartość kationów sodu oraz anionów węglanowych w opisanym roztworze. Wyniki podaj z dokładnością do trzech cyfr znaczących. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie procentu wagowego kwasu nadtlenosiarkowego w powstałym w wyniku reakcji chemicznej roztworze
W celu usunięcia pozostałości organicznych ze szkła laboratoryjnego stosuje się tzw. roztwór piranię (ang. piranha solution). Jest to mieszanina 96-procentowego roztworu kwasu siarkowego(VI) o gęstości 1,84 g/cm3 i perhydrolu, czyli 30-procentowego roztworu nadtlenku wodoru o gęstości 1,11 g/cm3. Oba składniki roztworu pirania miesza się w stosunku objętościowym (odpowiednio) 7:3, a produktem przebiegającej reakcji chemicznej jest kwas nadtlenosiarkowy (H2SO5) oraz woda.
Na podstawie: A. Asgar i inni, Photodefinable polydimethylsiloxane (PDMS) for rapid lab-on-a-chip prototyping, Lab on a Chip 2007.
Zakładając 100% wydajność przebiegającej reakcji chemicznej, oblicz procent wagowy kwasu nadtlenosiarkowego w uzyskanym roztworze. Wynik podaj z dokładnością do pierwszego miejsca po przecinku. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone

