Obliczanie zawartości procentowej tlenku manganu(IV) w mieszaninie uzyskanej po przerwaniu reakcji rozkładu manganianu(VII) potasu. Temat I - skład mieszaniny po przerwaniu reakcji chemicznej
Przeprowadzono doświadczenie chemiczne, którego schemat ilustruje rysunek poniżej.
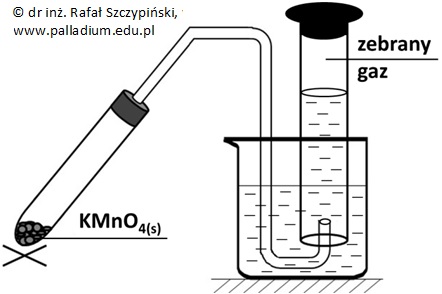
Rozkładowi termicznemu poddano próbkę manganianu(VII) potasu o masie 7,11 g. Wydzielający się gaz zbierano w cylindrze miarowym o pojemności 1 dm3, przy czym reakcję przerwano w momencie, gdy gaz stanowił 49,8% pojemności naczynia (80 oC, 1031 hPa). Opisana reakcja rozkładu przebiegła zgodnie z równaniem stechiometrycznym:
2KMnO4 ⟶ K2MnO4 + MnO2 + O2↑
Oblicz procent wagowy tlenku manganu(IV) w mieszaninie ciał stałych, jaka znajdowała się w probówce po przerwaniu ogrzewania jej zawartości. Wynik podaj z dokładnością do jednego miejsca po przecinku. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie stopnia przereagowania tlenku srebra(I) powstałego w wyniku reakcji rozkładu węglanu srebra. Temat I - stopień przereagowania
Węglan srebra ulega rozkładowi według schematu:
Ag2CO3 → Ag2O + CO2
Powstały tlenek srebra(I) jest nietrwały i już w temperaturze poniżej 500 K ulega dalszemu rozkładowi z utworzeniem metalicznego srebra oraz tlenu.
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2010.
Przygotowano dwie nieidentyczne próbki węglanu srebra o masie 13,8 g każda i poddano prażeniu w temperaturze bliskiej 500 K, przy czym pierwszą z próbek prażono o kilka minut krócej niż drugą. W efekcie uzyskano mieszaniny substancji stałych o masach (odpowiednio) 11,48 g oraz 10,96 g. Do każdej z tych mieszanin wprowadzono następnie nadmiar roztworu kwasu solnego. Z pierwszego z naczyń wydzieliło się 224 cm3 (warunki normalne) bezbarwnego, bezwonnego gazu powodującego mętnienie wody wapiennej.
Podaj numer próbki, z której po dodaniu kwasu solnego wydzielił się gaz powodujący mętnienie wody wapiennej, a następnie na podstawie niezbędnych obliczeń ustal wyrażając w procentach stopień rozkładu tlenku srebra w tej próbce. Wynik podaj z dokładnością do trzech cyfr znaczących. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie masy srebra w poreakcyjnej mieszaninie powstałej w wyniku kilku reakcji następczych. Temat I - skład mieszaniny po przerwaniu reakcji chemicznej
Węglan srebra ulega rozkładowi według schematu:
Ag2CO3 → Ag2O + CO2
Powstały tlenek srebra(I) jest nietrwały i już w temperaturze poniżej 500 K ulega dalszemu rozkładowi z utworzeniem metalicznego srebra oraz tlenu.
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2010.
Przygotowano dwie nieidentyczne próbki węglanu srebra o masie 13,8 g każda i poddano prażeniu w temperaturze bliskiej 500 K, przy czym pierwszą z próbek prażono o kilka minut krócej niż drugą. W efekcie uzyskano mieszaniny substancji stałych o masach (odpowiednio) 11,48 g oraz 10,96 g. Do każdej z tych mieszanin wprowadzono następnie nadmiar roztworu kwasu solnego. Z pierwszego z naczyń wydzieliło się 224 cm3 (warunki normalne) bezbarwnego, bezwonnego gazu powodującego mętnienie wody wapiennej.
Ustal zawartość procentową srebra w poreakcyjnej mieszaninie substancji stałych uzyskanej w wyniku prażenia tej próbki, z której nie zaobserwowano wydzielania się gazu po dodaniu kwasu solnego. Wynik podaj z dokładnością do pierwszego miejsca po przecinku. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Przerwana reakcja rozkładu manganianu(VII) potasu. Temat I - skład mieszaniny po przerwaniu reakcji chemicznej
Odważono 3,95 g manganianu(VII) potasu i poddano termicznemu rozkładowi zgodnie z równaniem:
2KMnO4 ⟶ K2MnO4 + MnO2 + O2
Po zakończeniu doświadczenia stwierdzono, że w mieszaninie poreakcyjnej substancji stałych związek ten stanowił 21,8% masy.
Ile cm³ (warunki normalne) tlenu powstało? Wynik obliczeń podaj z dokładnością do cyfry jedności. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Określanie procentu wagowego jonów wapnia w mieszaninie poreakcyjnej uzyskanej w wyniku częściowego rozkładu węglanu wapnia. Temat I - skład mieszaniny po przerwaniu reakcji chemicznej
W otwartym naczyniu prowadzono termiczny rozkład 4 g węglanu wapnia. Po pewnym czasie reakcję przerwano, stwierdzając, że stopień przereagowania substratu wynosi 30%.
Oblicz zawartość jonów wapnia w poreakcyjnej mieszaninie substancji stałych. Wynik wyraź w procentach wagowych, stosując przybliżenie do pierwszego miejsca po przecinku. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Ocena poprawności zdań dotyczących analizy termograwimetrycznej próbki gipsu krystalicznego. Temat I - skład mieszaniny w reakcjach chemicznych
Jedną z metod analizy termicznej jest termograwimetria. Technika ta polega na ogrzewaniu ze stałą szybkością próbki i rejestrowaniu zmian jej masy w funkcji czasu lub temperatury. Uzyskane dane pomiarowe przedstawia się w formie wykresu zwanego krzywą termograwimetryczną (TG). Termograwimetrię można zastosować do analizy stopnia uwodnienia hydratów. Na przykład gips krystaliczny CaSO4·2H2O ulega dwuetapowemu odwodnieniu. W pierwszym etapie następuje częściowe odwodnienie próbki, w efekcie dochodzi do utworzenia się hydratu o mniejszym stopniu uwodnienia i masie mniejszej o 15,7% względem wyjściowego substratu. W drugim etapie, podczas dalszego ogrzewania powstaje sól bezwodna.
Na podstawie: N. Okubo, Measuring crystal water in hydrates by thermogravimetry, Tokyo 1993.
Oceń poprawność poniższych zdań wpisując literę „P” (prawda) lub literę „F” (fałsz). 1. Gdy próbka czystego gipsu krystalicznego poddanego badaniu termograwimetrycznemu utraci 5% masy, zawierać będzie w swym składzie co najmniej dwa hydraty. 2. Hydrat uzyskany w pierwszym etapie doświadczenia jest mniej trwały termicznie niż gips krystaliczny. 3. Procent wagowy jonów wapnia w próbce zmienia się w trakcie przebiegu doświadczenia, ale ich masa jest stała. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Określanie wzoru hydratu powstałego jako produkt pośredni podczas badania termograwimetrycznego. Temat I - ustalanie wzoru hydratu
Jedną z metod analizy termicznej jest termograwimetria. Technika ta polega na ogrzewaniu ze stałą szybkością próbki i rejestrowaniu zmian jej masy w funkcji czasu lub temperatury. Uzyskane dane pomiarowe przedstawia się w formie wykresu zwanego krzywą termograwimetryczną (TG). Termograwimetrię można zastosować do analizy stopnia uwodnienia hydratów. Na przykład gips krystaliczny CaSO4·2H2O ulega dwuetapowemu odwodnieniu. W pierwszym etapie następuje częściowe odwodnienie próbki, w efekcie dochodzi do utworzenia się hydratu o mniejszym stopniu uwodnienia i masie mniejszej o 15,7% względem wyjściowego substratu. W drugim etapie, podczas dalszego ogrzewania powstaje sól bezwodna.
Na podstawie: N. Okubo, Measuring crystal water in hydrates by thermogravimetry, Tokyo 1993.
Na podstawie niezbędnych obliczeń ustal wzór hydratu uzyskiwanego w pierwszym etapie analizy termograwimetrycznej próbki gipsu krystalicznego. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Określanie czystości próbki gipsu krystalicznego na podstawie analizy termograwimetrycznej. Temat I - skład mieszaniny w reakcjach chemicznych
Jedną z metod analizy termicznej jest termograwimetria. Technika ta polega na ogrzewaniu ze stałą szybkością próbki i rejestrowaniu zmian jej masy w funkcji czasu lub temperatury. Uzyskane dane pomiarowe przedstawia się w formie wykresu zwanego krzywą termograwimetryczną (TG). Termograwimetrię można zastosować do analizy stopnia uwodnienia hydratów. Na przykład gips krystaliczny CaSO4·2H2O ulega dwuetapowemu odwodnieniu. W pierwszym etapie następuje częściowe odwodnienie próbki, w efekcie dochodzi do utworzenia się hydratu o mniejszym stopniu uwodnienia i masie mniejszej o 15,7% względem wyjściowego substratu. W drugim etapie, podczas dalszego ogrzewania powstaje sól bezwodna.
Na podstawie: N. Okubo, Measuring crystal water in hydrates by thermogravimetry, Tokyo 1993.
Badaniu termograwimetrycznemu poddano próbkę zanieczyszczonego gipsu krystalicznego o masie 2,24 g. Po zakończeniu doświadczenia stwierdzono, że masa stałej pozostałości wynosi 1,79 g.
Wiedząc, że zanieczyszczenia są trwałe termicznie w warunkach prowadzonego eksperymentu, określ na podstawie niezbędnych obliczeń czystość próbki gipsu krystalicznego jaka została poddana analizie termograwimetrycznej. Wynik wyraź w procentach wagowych. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Ustalanie wzoru sumarycznego soli na podstawie analizy termograwimetrycznej. Temat I - ustalanie wzoru empirycznego (elementarnego) oraz rzeczywistego
Jedną z metod analizy termicznej jest termograwimetria. Technika ta polega na ogrzewaniu ze stałą szybkością próbki i rejestrowaniu zmian jej masy w funkcji czasu lub temperatury. Uzyskane dane pomiarowe przedstawia się w formie wykresu zwanego krzywą termograwimetryczną (TG). Termograwimetrię można zastosować do określania wzorów sumarycznych związków chemicznych. Podczas jednego z eksperymentów badaniu poddano próbkę pewnej soli, której krzywa termograwimetryczna ma następujący przebieg:
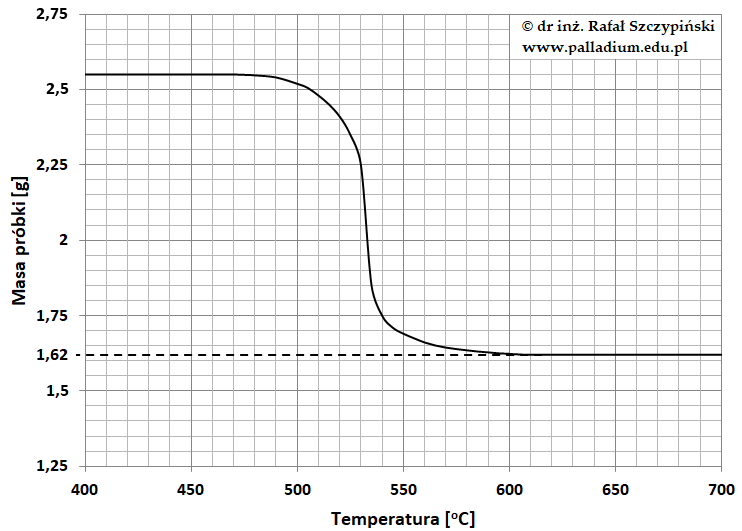
Na podstawie: W. Szczepaniak, Metody instrumentalne w analizie chemicznej, Warszawa 2012.
Ustalono ponadto, że w warunkach prowadzonego eksperymentu wydzieliła się czerwonobrunatna mieszanina dwóch gazów, która po przepuszczeniu przez płuczkę zawierającą wodny roztwór wodorotlenku potasu spowodowała przyrost jej masy o 690 mg, zaś podtrzymujący palenie gaz, jaki opuścił płuczkę zajął w warunkach normalnych objętość 168 cm3.
Wiedząc, że stałym produktem uzyskanym w wyniku przeprowadzonego eksperymentu było metaliczne srebro, ustal na podstawie niezbędnych obliczeń wzór sumaryczny soli poddanej analizie termograwimetrycznej. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie procentowego składu wagowego mieszaniny hydratów siarczanu(VI) miedzi(II) poddanej prażeniu. Temat I - skład mieszaniny w reakcjach chemicznych
Z pojemnika zawierającego 250 g mieszaniny dwóch hydratów: CuSO4 · 3H2O oraz CuSO4 · 5H2O odważono dwie próbki o masie 7,32 g każda. Pierwszą z nich umieszczono w tyglu porcelanowym, a drugą rozłożono równomiernie na ceramicznej płytce wykonanej z tego samego materiału, co tygiel. Obie próbki wprowadzono do pieca i poddano całkowitemu odwodnieniu w temperaturze 170 oC. Po zakończeniu doświadczenia stwierdzono, że masy uzyskanych w obu naczyniach białych substancji stałych stanowiły po 65,6% masy każdej z mieszanin poddanych prażeniu.
Oblicz procentowy skład wagowy mieszaniny hydratów poddanej odwodnieniu. Wynik podaj z dokładnością do trzech cyfr znaczących. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie procentowego składu wagowego stopu magnezu z glinem. Temat I - skład mieszaniny w reakcjach chemicznych
Na 9 g próbki stopu magnezu z glinem podziałano nadmiarem kwasu solnego. W wyniku przebiegających reakcji chemicznych wydzieliło się 10,64 dm3 wodoru (warunki normalne).
Oblicz procentowy skład wagowy stopu poddanego analizie. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Określanie procentowego składu wagowego mieszaniny soli miedzi(II) na drodze reakcji strąceniowej. Temat I - skład mieszaniny w reakcjach chemicznych
Próbkę o masie 10,82 g bezwodnych soli miedzi(II) – siarczanu(VI) oraz azotanu(V) rozpuszczono w wodzie destylowanej. Do powstałego układu wprowadzono roztwór zasady potasowej. Zaobserwowano strącenie się niebieskiego, galaretowatego ciała stałego oraz odbarwienie roztworu. Uzyskaną zawiesinę ogrzano, a następnie powstałe czarne ciało stałe przesączono, przemyto, wysuszono i zważono. Jego masa była równa 4,68 g.
Wiedząc, że wydajność procesu sączenia wyniosła 90%, ustal na podstawie niezbędnych obliczeń procentowy skład wagowy mieszaniny soli przed rozpuszczeniem jej w wodzie destylowanej. Wyniki podaj z dokładnością do trzech cyfr znaczących. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie objętości powstałego dwutlenku węgla w reakcji kwasu bromowodorowego z zanieczyszczonym węglanem wapnia. Temat I - skład mieszaniny w reakcjach chemicznych
Próbkę o masie 7,31 g stanowiącą węglan wapnia zanieczyszczony wodorowęglanem wapnia poddano działaniu nadmiaru kwasu bromowodorowego. W układzie przebiegły wówczas reakcje chemiczne opisane równaniami:
CaCO3 + 2HBr ⟶ CaBr2 + H2O + CO2
Ca(HCO3)2 + 2HBr ⟶ CaBr2 + 2H2O + 2CO2
Po zakończeniu wydzielania się pęcherzyków gazu wodę odparowano, a zawartość naczynia wyprażono do stałej masy, uzyskując w ten sposób 14 g bromku wapnia.
Wiedząc, że objętość molowa gazu w temperaturze 19 oC pod ciśnieniem normalnym wynosi 24 dm3, oblicz, jaką objętość w opisanych warunkach zajmuje powstały tlenek węgla(IV)? Wynik podaj w dm3 z dokładnością do dwóch cyfr znaczących. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie procentowego składu wagowego brązu na podstawie udziałów procentowych tlenków metali. Temat I - skład mieszaniny w reakcjach chemicznych
Brązy to stopy miedzi z cyną. Redukcji poddano mieszaninę tlenków – SnO oraz CuO, w której procent wagowy tlenku miedzi(II) wynosił 91,8%.
Na podstawie niezbędnych obliczeń ustal procentowy skład wagowy uzyskanego w ten sposób brązu. Wynik podaj z dokładnością do cyfry jedności. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Ustalanie składu procentowego stopu uzyskanego w wyniku redukcji tlenków metali. Temat I - skład mieszaniny w reakcjach chemicznych
Korund to minerał, którego głównym składnikiem jest tlenek glinu. Substancja ta może zawierać również domieszki innych związków chemicznych, na przykład – tlenku tytanu(IV).
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2010.
W wyniku redukcji wodorem próbki korundu o masie 19 g, uzyskano 18 dm3 pary wodnej (394 K, 1000 hPa).
Ustal procentowy skład wagowy uzyskanego stopu glinu z tytanem. Wyniki obliczeń podaj z dokładnością do czterech cyfr znaczących. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone

