Ustalanie wzoru hydratu chlorku żelaza(III) na podstawie kilku reakcji następczych. Temat I - wydajność reakcji, proces wieloetapowy
W celu ustalenia wzoru hydratu chlorku żelaza(III) na wodny roztwór powstały w wyniku rozpuszczenia 4,51 g tego hydratu podziałano nadmiarową ilością roztworu wodorotlenku sodu. Osad przemyto, wyprażono i zważono. Masa uzyskanego w ten sposób tlenku żelaza(III) wynosiła 1,06 g.
Określ wzór hydratu, jeśli całkowita wydajność procesu prowadzącego do otrzymania tlenku wyniosła 80%. Rozwiązanie tego zadania dostępne jest nieodpłatnie pod poniższym linkiem: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie objętości gazowych produktów reakcji rozkładu w różnych warunkach. Temat I - skład mieszaniny w reakcjach chemicznych
W skład proszku do pieczenia wchodzą zwykle dwa związki chemiczne – wodorowęglan sodu (soda oczyszczona) lub wodorowęglan amonu (tzw. amoniak do pieczenia). W temperaturze wypieku równej 180 oC oba rozkładają się z wydzieleniem gazowych produktów, przy czym podczas rozkładu sody oczyszczonej powstaje dodatkowo związek chemiczny o stałym stanie skupienia, zawierający 43,4% sodu.
Do wypieku 600 g ciasta (1000 hPa) wykorzystano 15 g wodorowęglanu amonu. Gazowe produkty reakcji jego rozkładu spowodowały spulchnienie ciasta.
Jaką objętość będą zajmować poszczególne produkty rozkładu wodorowęglanu amonu w warunkach normalnych oraz w warunkach wypieku ciasta? © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie masy substratu niezbędnej do otrzymania określonej objętości gazowych produktów. Temat I - skład mieszaniny w reakcjach chemicznych
W skład proszku do pieczenia wchodzą zwykle dwa związki chemiczne – wodorowęglan sodu (soda oczyszczona) lub wodorowęglan amonu (tzw. amoniak do pieczenia). W temperaturze wypieku równej 180 oC oba rozkładają się z wydzieleniem gazowych produktów, przy czym podczas rozkładu sody oczyszczonej powstaje dodatkowo związek chemiczny o stałym stanie skupienia, zawierający 43,4% sodu.
Do wypieku 600 g ciasta (1000 hPa) wykorzystano 15 g wodorowęglanu amonu. Gazowe produkty reakcji jego rozkładu spowodowały spulchnienie ciasta.
Oblicz masę sody oczyszczonej jakiej należy użyć, aby objętość gazowych produktów powstałych w warunkach wypieku ciasta była taka sama, jak podczas wykorzystania tzw. amoniaku do pieczenia. Wynik podaj z dokładnością do trzech cyfr znaczących. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie sumarycznej objętości produktów powstałych podczas dwóch etapów doświadczenia. Temat I - skład mieszaniny w reakcjach chemicznych
Tak zwany antymon metaliczny otrzymuje się w dwuetapowym procesie reakcyjnym, z wyjściowego surowca, jakim jest siarczek antymonu(III) – antymonit:
Sb2S3 + 5O2 → Sb2O4 + 3SO2 (etap I)
Sb2O4 + 4C → 2Sb + 4CO (etap II)
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2010.
Oblicz sumaryczną objętość gazowych produktów (warunki normalne), jakie uzyskano w wyniku przebiegu tego procesu, jeśli wykorzystano 7,64 g rudy zawierającej 11% zanieczyszczeń, które w opisanych warunkach nie wchodzą w reakcję chemiczną. Wynik obliczeń zaokrąglij do drugiego miejsca po przecinku. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie objętości gazu w baloniku powstałego w reakcji azotku magnezu z wodą. Temat I - skład mieszaniny w reakcjach chemicznych
Na pewną ilość azotku magnezu (Mg3N2) podziałano w nadmiarze wodą z dodatkiem kilku kropli alkoholowego roztworu fenoloftaleiny. W opisanych warunkach prowadzonego doświadczenia oprócz wodorotlenku magnezu powstał również bezbarwny gaz o charakterystycznej, drażniącej woni, który zbierano w baloniku (rysunek poniżej). Po zakończeniu reakcji balonik zamknięto, wypuszczono i zaobserwowano jego unoszenie się do góry. Pozostałą w kolbie mieszaninę wyprażono do stałej masy i uzyskano 10 g białej substancji, w której jony magnezowe stanowiły 60% (procenty wagowe).
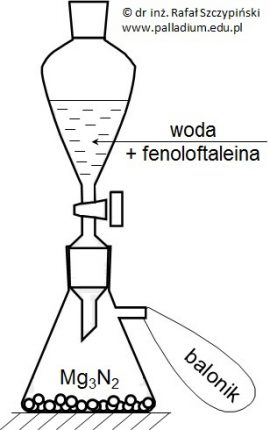
Oblicz, jaką objętość (warunki normalne) miał wypełniony gazem balonik, jeśli 10% tej substancji pozostało w kolbie? Wynik obliczeń podaj z dokładnością do trzech cyfr znaczących. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie niezbędnej do przeprowadzenia reakcji chemicznej objętości powietrza. Temat I - skład mieszaniny w reakcjach chemicznych
Antymon może występować w tzw. żółtej postaci tworząc kilkuatomowe cząsteczki. Taką odmianę alotropową antymonu otrzymuje się w reakcji jego wodorku o wzorze SbH3 (antymonowodoru) z ciekłym tlenem, przy czym stosunek molowy powstałych produktów reakcji (antymonu oraz wody) wynosi odpowiednio 1:6.
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2010.
Jakiej objętości powietrza odmierzonego w warunkach normalnych należy użyć, w celu uzyskania 61 g antymonu? Wynik obliczeń podaj z dokładnością do cyfry jedności. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie zawartości pierwiastka w próbce mieszaniny użytej do reakcji chemicznej. Temat I - skład mieszaniny w reakcjach chemicznych
W celu oczyszczenia próbki srebra zanieczyszczonej tlenkami ZnO oraz CuO, w jednym z etapów procesu poddaje się ją działaniu nadmiaru roztworu kwasu solnego. W wyniku działania kwasu solnego na próbkę zanieczyszczonego srebra powstał roztwór zawierający 13,6 g chlorku cynku oraz 6,75 g chlorku miedzi(II).
Oblicz liczbę atomów srebra w próbce, jeśli wymienione zanieczyszczenia stanowiły 20% jej masy. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie masy powstałego tlenku azotu(IV) na podstawie znanej masy oraz objętości mieszaniny substratów. Temat I - skład mieszaniny w reakcjach chemicznych
Reakcja utleniania tlenku azotu(II) ozonem przebiega zgodnie z równaniem:
NO + O3 → NO2 + O2
Oblicz, jaką masę tlenku NO2 otrzymano, jeśli przygotowana mieszanina substratów o masie 32,4 g w temperaturze 303 K i pod ciśnieniem 1007 hPa zajmowała objętość 20 dm3? Przyjmij, że uniwersalna stała gazowa ma wartość 83,1 hPa∙dm3∙mol–1∙K–1. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Objętość wodoru zużytego do redukcji mieszaniny tlenków ołowiu. Reakcja z mieszaniną o nieznanym składzie ilościowym. Temat I - skład mieszaniny w reakcjach chemicznych
W wyniku redukcji 11,47 g mieszaniny tlenków PbO i PbO2 wodorem uzyskano 1,26 cm3 wody (warunki normalne). Podczas opisanego eksperymentu przebiegły reakcje chemiczne:
PbO + H2 → Pb + H2O
PbO2 + 2H2 → Pb + 2H2O
Oblicz, jaka objętość odmierzonego w warunkach normalnych wodoru została zużyta podczas opisanego eksperymentu? Wynik podaj w centymetrach sześciennych. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie objętości mieszaniny gazów niezbędnej do reakcji z określoną masą magnezu. Temat I - skład mieszaniny w reakcjach chemicznych
Mieszaninę gazów, w której na 3 cząsteczki azotu przypadały 2 cząsteczki tlenu poddano reakcji z próbką magnezu o masie 18 g. W układzie przebiegły dwie reakcje chemiczne:
2Mg + O2 → 2MgO oraz 3Mg + N2 → Mg3N2
Oblicz, jaką objętość zajmowała wyjściowa mieszanina gazów w temperaturze 298 K pod ciśnieniem normalnym. Wynik wyraź w dm3 z dokładnością do cyfry jedności. Rozwiązanie tego zadania dostępne jest nieodpłatnie pod poniższym linkiem: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie objętości powstałego azotu w przerwanej reakcji rozkładu dwuchromianu(VI) amonu. Temat I - skład mieszaniny po przerwaniu reakcji chemicznej
Reakcję termicznego rozkładu dwuchromianu(VI) amonu przedstawia równanie stechiometryczne:
(NH4)2Cr2O7 ⟶ Cr2O3 + N2 + 4H2O
Rozkładowi poddano 3,15 g substratu.
Oblicz objętość azotu (800 K, 1010 hPa) jaka powstała w tym doświadczeniu, jeśli w poreakcyjnej mieszaninie substancji stałych tlenek chromu(III) stanowił 70,7% masy. Wynik podaj w centymetrach sześciennych z przybliżeniem do cyfry jedności. Przyjmij, że uniwersalna stała gazowa ma wartość równą 83,1 hPa∙dm3∙mol–1∙K–1. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie, jaki procent początkowej ilości substratu uległ rozkładowi, gdy przerwano reakcję chemiczną. Temat I - skład mieszaniny po przerwaniu reakcji chemicznej
Na skalę laboratoryjną tlenek chromu(III) otrzymuje się podczas termicznego rozkładu dwuchromianu(VI) amonu:
(NH4)2Cr2O7 ⟶ Cr2O3 + N2 + 4H2O
Przez 10 sekund w tyglu porcelanowym prażono 12,6 g dwuchromianu(VI) amonu. Po tym czasie reakcję wstrzymano przez gwałtowne schłodzenie zawartości naczynia, a następnie ostrożnie odparowano powstałą wodę. Masa stałej pozostałości wynosiła 9,27 g.
Oblicz, jaki procent masy dwuchromianu(VI) amonu uległ rozkładowi? Wynik podaj z dokładnością do trzech cyfr znaczących. Rozwiązanie tego zadania dostępne jest nieodpłatnie pod poniższym linkiem: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie objętości wydzielonego azotu do momentu wstrzymania reakcji rozkładu dwuchromianu(VI) amonu. Temat I - skład mieszaniny po przerwaniu reakcji chemicznej
Na skalę laboratoryjną tlenek chromu(III) otrzymuje się podczas termicznego rozkładu dwuchromianu(VI) amonu:
(NH4)2Cr2O7 ⟶ Cr2O3 + N2 + 4H2O
Przez 10 sekund w tyglu porcelanowym prażono 12,6 g dwuchromianu(VI) amonu. Po tym czasie reakcję wstrzymano przez gwałtowne schłodzenie zawartości naczynia, a następnie ostrożnie odparowano powstałą wodę. Masa stałej pozostałości wynosiła 9,27 g.
Oblicz, jaką objętość (w przeliczeniu na warunki normalne) zajął powstały azot? Wynik podaj w centymetrach sześciennych z dokładnością do cyfry jedności. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Stosunek molowy stałych składników w mieszaninie poreakcyjnej po przerwaniu reakcji rozkładu dwuchromianu(VI) amonu
Na skalę laboratoryjną tlenek chromu(III) otrzymuje się podczas termicznego rozkładu dwuchromianu(VI) amonu:
(NH4)2Cr2O7 ⟶ Cr2O3 + N2 + 4H2O
Przez 10 sekund w tyglu porcelanowym prażono 12,6 g dwuchromianu(VI) amonu. Po tym czasie reakcję wstrzymano przez gwałtowne schłodzenie zawartości naczynia, a następnie ostrożnie odparowano powstałą wodę. Masa stałej pozostałości wynosiła 9,27 g.
Oblicz, w jakim stosunku molowym pozostawały względem siebie stałe składniki w uzyskanej mieszaninie poreakcyjnej? © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie stopnia przereagowania manganianu(VII) potasu w reakcji jego rozkładu. Temat I - stopień przereagowania
Przeprowadzono doświadczenie chemiczne, którego schemat ilustruje rysunek poniżej.
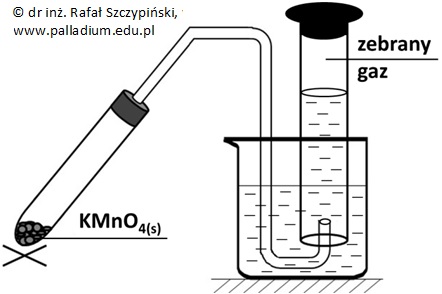
Rozkładowi termicznemu poddano próbkę manganianu(VII) potasu o masie 7,11 g. Wydzielający się gaz zbierano w cylindrze miarowym o pojemności 1 dm3, przy czym reakcję przerwano w momencie, gdy gaz stanowił 49,8% pojemności naczynia (80 oC, 1031 hPa). Opisana reakcja rozkładu przebiegła zgodnie z równaniem stechiometrycznym:
2KMnO4 ⟶ K2MnO4 + MnO2 + O2↑
Oblicz stopień przereagowania manganianu(VII) potasu do chwili, gdy przerwano rozkład tego związku chemicznego. Wynik podaj w procentach z dokładnością do trzech cyfr znaczących. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone

