Obliczanie masy magnetytu niezbędnej do uzyskania określonej objętości wody przy danej wydajności reakcji. Temat I - wydajność reakcji
W pewnych warunkach reakcja redukcji magnetytu wodorem przebiega zgodnie z równaniem stechiometrycznym:
Fe3O4 + 4H2 → 3Fe + 4H2O
W wyniku redukcji wodorem pewnej masy magnetytu, według opisanego równania reakcji chemicznej powstało 4,32 cm3 wody destylowanej.
Oblicz, jaka masa magnetytu została odważona, jeśli reakcja przebiegła z 80% wydajnością, a pomiaru objętości wody dokonano w temperaturze 277 K pod ciśnieniem normalnym? © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie wydajności reakcji cynku z kwasem solnym. Temat I - wydajność reakcji
Roztworzono 3,25 g cynku w kwasie solnym, a powstały produkt gazowy zajął objętość w warunkach normalnych równą 1064 cm3.
Oblicz procentową wydajność opisanego procesu. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie masy ołowiu, gdy znana jest wydajność reakcji oraz ilość substratu. Temat I - wydajność reakcji
Przeprowadzono redukcję dwóch moli tlenku ołowiu(II) zgodnie z równaniem:
PbO + C → CO + Pb
Oblicz masę powstałego metalu, jeśli wydajność opisanego procesu wyniosła 85%. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie wydajności reakcji syntezy metanolu na podstawie masy mieszaniny substratów oraz ilości nieprzereagowanego substratu. Temat I - wydajność reakcji
Metanol można otrzymać z gazu syntezowego zgodnie z równaniem:
CO + 2H2 → CH3OH
W celu przeprowadzenia syntezy metanolu przygotowano 24 g stechiometrycznej mieszaniny tlenku węgla(II) i wodoru. Po zakończeniu procesu stwierdzono, że pozostały wodór w warunkach normalnych zajmuje objętość 6,72 dm3.
Ustal na podstawie niezbędnych obliczeń wydajność opisanej reakcji syntezy metanolu. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie masy żelaza jaką można uzyskać z określonej ilości koksu w procesie wielkopiecowym. Temat I - wydajność reakcji
Do redukcji tlenku żelaza(III) w procesie wielkopiecowym używa się koksu, czyli mieszaniny stanowiącej pierwiastkowy węgiel wraz z niewielką ilością zanieczyszczeń. Równanie jednej z przebiegających wówczas reakcji chemicznych, w wyniku której powstaje żelazo z wydajnością 60% można przedstawić w postaci:
Fe2O3 + 3C → 2Fe + 3CO
Oblicz, ile kilogramów żelaza można uzyskać w wyniku powyższej przemiany, jeśli dysponujemy 100 kg koksu zawierającego 6% zanieczyszczeń, które nie biorą udziału w reakcji chemicznej. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie wydajności procesu prowadzącego do uzyskania siarczanu(VI) baru po odsączeniu. Temat I - wydajność reakcji
Próbkę azotanu(V) baru, w której jony azotanowe(V) ważyły 2,79 g rozpuszczono w wodzie destylowanej. Uzyskany roztwór wprowadzono do wodnego roztworu siarczanu(VI) sodu zawierającego 2,84 g rozpuszczonej całkowicie soli. W naczyniu przebiegła reakcja chemiczna opisana równaniem:
Na2SO4 + Ba(NO3)2 ⟶ BaSO4↓ + 2NaNO3
Powstały osad odsączono, przemyto, wysuszono i zważono uzyskując w ten sposób 4,32 g siarczanu(VI) baru.
Oblicz procentową wydajność procesu prowadzącego do uzyskania podanej masy siarczanu(VI) baru. Wynik podaj z dokładnością do pierwszego miejsca po przecinku. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie wydajności reakcji rozkładu metanu. Temat I - wydajność reakcji
Do reaktora wprowadzono 8 g metanu. Zawartość naczynia ogrzano do temperatury T, co poskutkowało przebiegiem reakcji chemicznej:
CH4(g) → C(s) + 2H2(g)
Po jej zakończeniu stwierdzono, że znajdujące się w układzie reagenty, gazowe zajmują objętość 16,8 dm3 w przeliczeniu na warunki normalne.
Oblicz procentową wydajność reakcji rozkładu metanu w opisanych warunkach. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie stopnia przereagowania substratów reakcji spalania amoniaku. Temat I - stopień przereagowania
Stopień przereagowania substratu w danej reakcji chemicznej jest to stosunek jego ilości jaka weszła w reakcję do ilości początkowej. Jeśli substraty zmieszane zostały w stosunku stechiometrycznym, wówczas wielkość ta równa jest co do wartości wydajności reakcji chemicznej. W jednym z etapów produkcji kwasu azotowego(V) przebiega reakcja chemiczna:
4NH3 + 5O2 → 4NO + 6H2O
Do reaktora o pojemności 1 m3 wprowadzono 11 moli mieszaniny amoniaku z powietrzem, w której substraty opisanej przemiany pozostawały w stosunku stechiometrycznym. Po zainicjowaniu reakcji chemicznej, a następnie jej zakończeniu stwierdzono, że powstało 1,44 mola tlenku azotu(II).
Określ procentowy stopień przereagowania każdego z substratów oraz wydajność reakcji. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie stopnia przereagowania nadmiarowego substratu reakcji karbidu z wodą. Temat I - stopień przereagowania
Stopień przereagowania substratu w danej reakcji chemicznej jest to stosunek jego ilości jaka weszła w reakcję do ilości początkowej. Jeśli substraty zmieszane zostały w stosunku stechiometrycznym, wówczas wielkość ta równa jest co do wartości wydajności reakcji chemicznej. Karbid reaguje z wodą zgodnie z równaniem:
CaC2 + 2H2O → Ca(OH)2 + C2H2
W kolbie odważono 16 g pokruszonego karbidu, następnie ostrożnie, małymi porcjami wprowadzono jeszcze 12 cm3 wody destylowanej. Powstały acetylen zebrano i zmierzono jego objętość, która w temperaturze 25 oC pod ciśnieniem normalnym wynosiła 5,96 dm3.
Oblicz procentowy stopień przereagowania nadmiarowego substratu. Wynik podaj z dokładnością do trzech cyfr znaczących. Rozwiązanie tego zadania dostępne jest nieodpłatnie pod poniższym linkiem: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie całkowitej wydajności procesu wieloetapowego. Temat I - wydajność reakcji, proces wieloetapowy
Pewien związek chemiczny X uzyskuje się w trójetapowym procesie chemicznym:
Etap 1: A + B → 2C + D
Etap 2: C + E → F
Etap 3: 3F + 2Y → 2X + G
Oblicz całkowitą wydajność procesu prowadzącego do utworzenia związku chemicznego X, jeśli wydajności poszczególnych etapów reakcyjnych wynoszą kolejno: 70%, 90% oraz 65%. Wynik podaj z dokładnością do cyfry jedności. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie ilości pierwiastka uzyskanego w wieloetapowym procesie reakcyjnym. Temat I - wydajność reakcji, proces wieloetapowy
Tak zwany antymon metaliczny otrzymuje się w dwuetapowym procesie reakcyjnym, z wyjściowego surowca, jakim jest siarczek antymonu(III) – antymonit:
Sb2S3 + 5O2 → Sb2O4 + 3SO2 (etap I)
Sb2O4 + 4C → 2Sb + 4CO (etap II)
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2010.
Uzasadnij obliczeniami, czy przy wydajności równej 90% każdego etapu reakcyjnego, możliwe jest uzyskanie 210 g antymonu, jeśli dysponujemy 400 g rudy o zawartości 85% antymonitu? Wynik zaokrąglij do pierwszego miejsca po przecinku. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie niezbędnej ilości substratu użytego w wieloetapowym procesie. Temat I - wydajność reakcji, proces wieloetapowy
Podczas reakcji kwasu siarkowego(VI) z chloranem(V) potasu powstaje nietrwały kwas chlorowy(V), który rozkłada się zgodnie z równaniem:
3HClO3 → 2ClO2 + HClO4 + H2O
Z uwagi na wybuchowy charakter rozkładu tlenku chloru(IV) w temperaturze bliskiej 333 K, konieczne jest zapewnienie stałej temperatury (273 K) układu reakcyjnego:
2ClO2 → Cl2 + 2O2
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2010.
Oblicz, jaką masę chloranu(V) potasu należy odważyć, aby przy wydajności każdego z etapów reakcyjnych równej 90%, otrzymać 14 dm3 chloru odmierzonego w warunkach normalnych? Wynik obliczeń podaj z dokładnością do cyfry jedności. Rozwiązanie tego zadania dostępne jest nieodpłatnie pod poniższym linkiem: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie, czy powstanie wystarczająca ilość azotu przeznaczonego do reakcji syntezy amoniaku. Temat I - wydajność reakcji
Na skalę laboratoryjną tlenek chromu(III) otrzymuje się podczas termicznego rozkładu dwuchromianu(VI) amonu:
(NH4)2Cr2O7 ⟶ Cr2O3 + N2 + 4H2O
Przez 10 sekund w tyglu porcelanowym prażono 12,6 g dwuchromianu(VI) amonu. Po tym czasie reakcję wstrzymano przez gwałtowne schłodzenie zawartości naczynia, a następnie ostrożnie odparowano powstałą wodę. Masa stałej pozostałości wynosiła 9,27 g.
Wykonując stosowne obliczenia określ, czy ilość azotu wydzielona w wyniku całkowitego rozkładu 12,6 g dwuchromianu(VI) amonu będzie wystarczająca, aby w reakcji z wodorem możliwe było uzyskanie z 75% wydajnością 1 dm3 amoniaku (w przeliczeniu na warunki normalne)? © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie minimalnej objętości wody użytej w reakcji z azotkiem magnezu. Temat I - wydajność reakcji, proces wieloetapowy
Na pewną ilość azotku magnezu (Mg3N2) podziałano w nadmiarze wodą z dodatkiem kilku kropli fenoloftaleiny. W opisanych warunkach prowadzonego doświadczenia oprócz wodorotlenku magnezu powstał również bezbarwny gaz o charakterystycznej, drażniącej woni, który zbierano w baloniku (rysunek obok). Po zakończeniu reakcji balonik zamknięto, wypuszczono i zaobserwowano jego unoszenie się do góry. Pozostałą w kolbie mieszaninę wyprażono do stałej masy i uzyskano 10 g białej substancji, w której jony magnezowe stanowiły 60% (procenty wagowe).
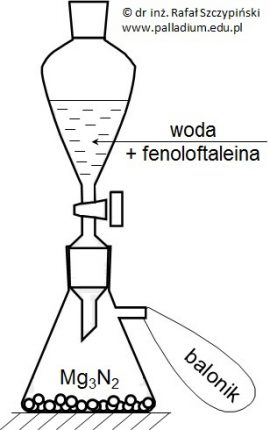
Załóżmy, że wydajność pierwszego etapu reakcyjnego wyniosła 100%, natomiast w drugim etapie reakcja biegła z 95% wydajnością.
Oblicz, jakiej minimalnej objętości wody (warunki normalne) należałoby użyć, w celu całkowitego przereagowania azotku magnezu? Wynik obliczeń podaj z dokładnością do pierwszego miejsca po przecinku. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Procentowa wydajność reakcji syntezy tlenku siarki(VI) obliczona na podstawie składu ilościowego mieszaniny reagentów. Temat I - wydajność reakcji
Ułamkiem molowym składnika mieszaniny nazywa się stosunek liczby moli tego składnika do sumarycznej liczby moli wszystkich składników mieszaniny. W wyniku prowadzonej w obecności katalizatora reakcji tlenu z tlenkiem siarki(IV) powstaje tlenek siarki(VI). Przygotowano 51,2 g mieszaniny substratów, w której procent wagowy tego o mniejszej masie cząsteczkowej wynosił 25%.
Oblicz procentową wydajność opisanej przemiany, jeśli ułamek molowy produktu w poreakcyjnej mieszaninie reagentów równy był 0,2. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone

