Przygotowanie roztworu zawierającego jony Zn2+ o określonym stężeniu molowym (blaszki). Podręcznik 8.2 zad. 5
Cynk jest metalem aktywniejszym od miedzi.
Wykonując stosowne obliczenia oraz dysponując wodą destylowaną, niezbędnym szkłem laboratoryjnym, blaszką cynkową o masie 5 g oraz 80 cm³ wodnego roztworu siarczanu(VI) miedzi(II) o stężeniu 0,25 mol∙dm–3, zaprojektuj doświadczenie, którego celem będzie uzyskanie roztworu o stężeniu jonów Zn2+ równym 0,2 mol∙dm–3. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Odróżnianie wodnych roztworów azotanu(V) srebra różniących się stężeniem molowym (blaszki). Podręcznik 8.2 zad. 6
W dwóch nieopisanych kolbach miarowych o pojemności 250 cm3 każda, znajdowały się jednakowe objętości wodnych roztworów azotanu(V) srebra o stężeniach 0,1 mol∙dm–3 oraz 0,5 mol∙dm–3.
Zaproponuj doświadczenie, którego celem będzie odróżnienie zawartości wymienionych naczyń, jeśli dysponujesz identycznymi blaszkami cynkowymi, wagą laboratoryjną, cylindrem miarowym oraz dwiema zlewkami. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Wybór metalu spełniającego odpowiednie warunki w reakcji z kwasem. Podręcznik 8.2 zad. 7
Dany jest zbiór metali: Zn, Cu, Ca, Cr, Al, Fe, Na, Mg.
Podaj symbole tych spośród wymienionych pierwiastków chemicznych, które spełniają niżej wymienione warunki. a) Reagują z rozcieńczonym roztworem H2SO4 „na gorąco”. b) W temperaturze pokojowej reagują ze stężonym roztworem HNO3. c) W podwyższonej temperaturze roztwarzają się w stężonym kwasie solnym. d) Nie reagują z rozcieńczonym roztworem kwasu ortofosforowego(V). © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Wybór odpowiedniego metalu spełniającego rolę powłoki zabezpieczającej stal przed korozją (korozja). Podręcznik 8.2 zad. 8
Podczas działania czynników atmosferycznych na elementy stalowe dochodzi do ich korozji elektrochemicznej.
Który metal spośród Cu, Ca, Zn, Pb zostałby przez Ciebie wykorzystany, w celu zabezpieczenia przed korozją stalowej blachy służącej do budowy dachu? Odpowiedź uzasadnij. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Odróżnianie roztworu kwasu siarkowego(VI) od roztworu wodorotlenku sodu. Podręcznik 8.3 zad. 1
W dwóch probówkach znajdowały się wodne roztwory – kwasu siarkowego(VI) oraz zasady sodowej.
Zaprojektuj doświadczenie, którego celem będzie odróżnienie zawartości wymienionych naczyń. W tym celu wybierz dwa spośród dostępnych odczynników: NaClO3(aq), KMnO4(aq), HNO3(aq), H2O2(aq), H3PO4(aq). Następnie podaj obserwacje oraz wnioski, wraz z zapisanymi w formie jonowej skróconej równaniami przebiegających reakcji chemicznych. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Opis obserwacji towarzyszących przeprowadzonemu doświadczeniu odróżniania rozcieńczonych roztworów wodorotlenków. Podręcznik 8.4 zad. 1
Przeprowadzono doświadczenie chemiczne, którego celem było odróżnienie rozcieńczonych, wodnych roztworów wodorotlenków – baru oraz potasu. W tym celu rozkładowi termicznemu poddano próbkę węglanu wapnia, a wydzielający się gazowy produkt wprowadzano do każdego z naczyń zawierających identyfikowane roztwory. Ogrzewanie węglanu przerwano, gdy w jednym z naczyń zarejestrowano objaw świadczący o przebiegającej w nim reakcji chemicznej.
Napisz, o jakim objawie przebiegu reakcji mowa jest w tekście wprowadzającym? Swoją odpowiedź uzasadnij równaniem reakcji chemicznej, zapisanym w formie jonowej skróconej. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Opis obserwacji towarzyszących przeprowadzonemu doświadczeniu oraz zapis równania przebiegającej reakcji chemicznej. Podręcznik 8.4 zad. 2
Przeprowadzono doświadczenie chemiczne, którego celem było odróżnienie rozcieńczonych, wodnych roztworów wodorotlenków – baru oraz potasu. W tym celu rozkładowi termicznemu poddano próbkę węglanu wapnia, a wydzielający się gazowy produkt wprowadzano do każdego z naczyń zawierających identyfikowane roztwory. Ogrzewanie węglanu przerwano, gdy w jednym z naczyń zarejestrowano objaw świadczący o przebiegającej w nim reakcji chemicznej.
Po zakończeniu opisanego doświadczenia postanowiono wznowić rozkład węglanu wapnia, przy czym wydzielającym się gazowym produktem nasycano wyłącznie zawartość tego naczynia, w którym uprzednio zaobserwowano objaw świadczący o przebiegającej w nim reakcji chemicznej.
Napisz, co zaobserwowano, jeśli do wymienionego układu reakcyjnego wprowadzono nadmiar gazu? Odpowiedź uzasadnij równaniem reakcji chemicznej, zapisanym w formie jonowej skróconej. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Określanie barwy papierka wskaźnikowego oraz dodatkowe obserwacje towarzyszące przeprowadzonemu doświadczeniu. Podręcznik 8.4 zad. 3
Przeprowadzono doświadczenie chemiczne, podczas którego do probówki zawierającej stały chlorek amonu wprowadzono nadmiar stężonego roztworu wodorotlenku potasu, a do probówki, w której znajdował się siarczan(IV) potasu – nadmiarową ilość roztworu kwasu bromowodorowego. Następnie, u wylotu każdego z naczyń umieszczono papierek wskaźnikowy.
Napisz, jaką barwę przyjął papierek oraz jakie inne obserwacje zanotowano podczas przebiegu tego eksperymentu? Wymień po dwie dla każdej z probówek. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Określanie składu ilościowego (molowego) dolomitu na podstawie przeprowadzonego eksperymentu. Podręcznik 8.4 zad. 4
W celu określenia składu chemicznego próbki dolomitu o masie 11,04 g wyprażono ją do stałej masy, równej 5,76 g.
Ustal na podstawie stosownych obliczeń liczby moli dwóch jedynych składników dolomitu – węglanu wapnia oraz węglanu magnezu. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Opis obserwacji towarzyszących przeprowadzonemu doświadczeniu z udziałem skorupki jaja kurzego oraz kwasów. Podręcznik 8.4 zad. 5
Do dwóch nieopisanych probówek zawierających 0,5-molowe roztwory kwasów – bromowodorowego (pierwsza probówka) oraz etanowego (druga probówka) wprowadzono identyczne porcje skorupek jaja kurzego.
Napisz, co zaobserwowano w każdym z wymienionych naczyń, jeśli kwasy zostały użyte w nadmiarze, w stosunku do skorupek? Podaj wspólny objaw reakcji chemicznej. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Odróżnianie roztworu kwasu bromowodorowego od roztworu kwasu etanowego. Podręcznik 8.4 zad. 6
Do dwóch nieopisanych probówek zawierających 0,5-molowe roztwory kwasów – bromowodorowego (pierwsza probówka) oraz etanowego (druga probówka) wprowadzono identyczne porcje skorupek jaja kurzego.
Oceń, czy możliwe byłoby wyłącznie poprzez ocenę wzrokową odróżnienie zawartości obu wymienionych naczyń podczas prowadzenia opisanego eksperymentu? Odpowiedź uzasadnij w 1-2 zdaniach. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Identyfikacja zawartości naczyń reakcyjnych za pomocą roztworu kwasu siarkowego(VI). Podręcznik 8.4 zad. 7
W czterech nieoznakowanych probówkach znajdują się krystaliczne substancje chemiczne o wzorach: Na2S, CaCO3, NaHCO3, NaNO2.
Dysponując jedynie wodnym roztworem kwasu siarkowego(VI), zaprojektuj doświadczenie, którego celem będzie identyfikacja zawartości każdego z wymienionych naczyń. W tym celu opisz spodziewane obserwacje oraz sformułuj wnioski. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Określanie odczynu znajdującego się w określonej probówce roztworu wraz z uzasadnieniem równaniem reakcji chemicznej. Podręcznik 8.4 zad. 8
Przeprowadzono doświadczenie opisane poniższym rysunkiem stosując takie ilości odczynników, że uzyskano klarowne roztwory wodne.
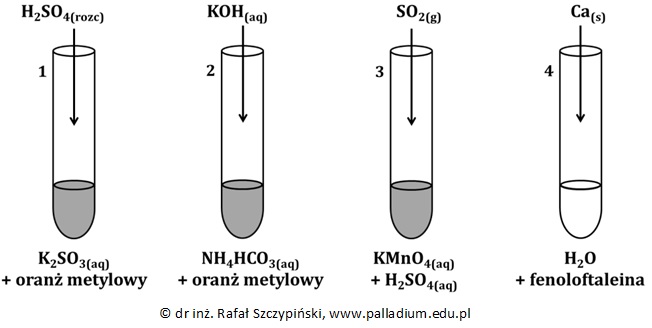
Podaj odczyn znajdującego się w probówce nr 1 roztworu przed rozpoczęciem doświadczenia. Odpowiedź uzasadnij równaniem reakcji chemicznej, zapisanym w formie jonowej skróconej. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone