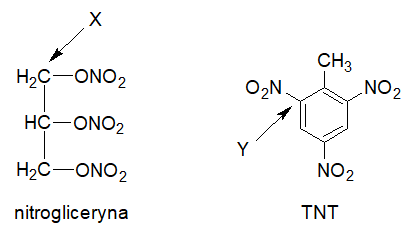
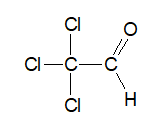
Zadanie 22. Arkusz Palladium kwiecień 2025 (2 punkty)
Przeprowadzono ciąg przemian chemicznych według schematu:
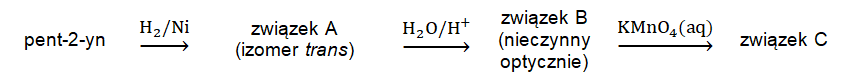
Narysuj wzory półstrukturalne (grupowe) cząsteczek związków chemicznych A, B oraz C. Uwzględnij, że substancja A jest określonym izomerem geometrycznym. Następnie oceń, czy w reakcji z udziałem związku A prowadzącej do powstania związku B obowiązuje reguła Markownikowa. Uzasadnij odpowiedź. Uzupełnij tabelę. Ocena z uzasadnieniem: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zadanie 23. Arkusz Palladium kwiecień 2025 (1 punkt)
Przeprowadzono ciąg przemian chemicznych według schematu:
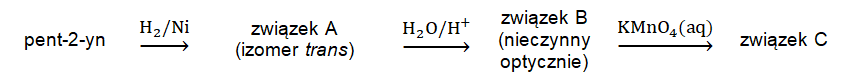
Opisz barwną zawartość naczynia reakcyjnego zawierającego wodny roztwór manganianu(VII) potasu przed dodaniem do niego związku chemicznego B oraz po uzyskaniu mieszaniny zawierającej związek C. Przed dodaniem związku chemicznego B: Mieszanina poreakcyjna: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zadanie 24.1. Arkusz Palladium kwiecień 2025 (1 punkt)
Zamieszczone rysunki przedstawiają struktury cząsteczek fenylometanolu oraz tymolu.
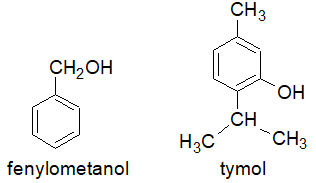
Oceń, czy cząsteczka fenylometanolu może być zarówno donorem, jak i akceptorem wiązania wodorowego. Odpowiedź uzasadnij odnosząc się do elementów jej budowy. Ocena oraz uzasadnienie odnośnie fenylometanolu jako donora wiązania wodorowego: Ocena oraz uzasadnienie odnośnie fenylometanolu jako akceptora wiązania wodorowego: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zadanie 24.2. Arkusz Palladium kwiecień 2025 (1 punkt)
Zamieszczone rysunki przedstawiają struktury cząsteczek fenylometanolu oraz tymolu.

Wyjaśnij, dlaczego przedstawione związki chemiczne nie są homologami? © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone