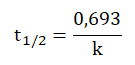Dawka pochłonięta promieniowania to energia zaabsorbowana przez próbkę wystawioną na działanie promieniowania, a jej jednostką jest grey (Gy). Stopień radiacyjnego uszkodzenia żywej tkanki zależy od typu promieniowania i rodzaju tkanki, dlatego w praktyce stosuje się tzw. równoważnik dawki (którego jednostką jest siwert, Sv), uwzględniający typ promieniowania, z którym związany jest współczynnik jakości promieniowania QF:
równoważnik dawki = QF ∙ dawka pochłonięta
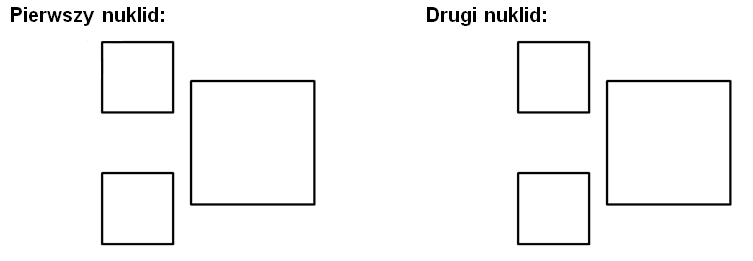
Przyjmuje się wówczas, że wartość QF dla promieniowania β oraz γ wynosi około 1, a dla promieniowania α wartość QF jest bliska 20. Im równoważnik dawki przyjmuje większą wartość, tym poddana działaniu promieniowania przez określony czas żywa tkanka będzie mieć większe uszkodzenia. Przykładami naturalnych nuklidów promieniotwórczych są 218Po oraz 208Tl, a okres półtrwania każdego z nich wynosi około 3 minut. W wyniku rozpadu pierwszego z wymienionych powstają atomy 214Pb, które ulegają kolejnej przemianie z utworzeniem izobaru zawierającego 83 elektrony. Z kolei z nuklidu 208Tl powstaje trwały izotop ołowiu zawierający 126 neutronów.
Na podstawie: P. Atkins, L. Jones, Chemia ogólna. Cząsteczki, materia, reakcje, Warszawa 2018 oraz A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2010.
Naturalne rozpady promieniotwórcze klasyfikowane są do reakcji I-rzędu. W przypadku takich przemian czas połowicznego rozpadu opisuje zależność:
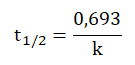
w której wielkość k jest stałą szybkości rozpadu promieniotwórczego.
Przez pewien czas obserwowano rozpad próbki stanowiącej 1 mol atomów nuklidu 214Pb. Rejestrowano wtedy liczbę wyemitowanych cząstek, które w polu elektrycznym odchylają się w kierunku dodatnio naładowanej elektrody. Uzyskane dane pomiarowe przedstawiono w postaci graficznej:
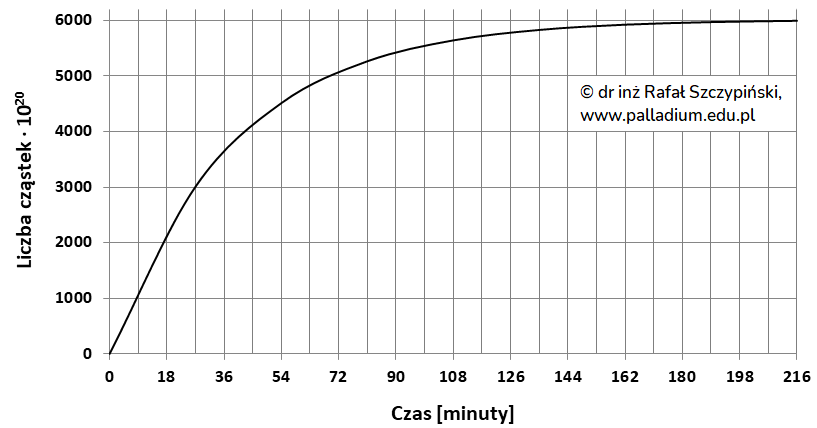
Na podstawie niezbędnych obliczeń ustal wartość stałej szybkości rozpadu tego nuklidu. Wynik podaj z jednostką, z dokładnością do trzech cyfr znaczących.
© dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone