Jedna z największych katastrof związanych z energetyką jądrową miała miejsce 26 kwietnia 1986 roku w elektrowni jądrowej w Czarnobylu. Nastąpiła wówczas emisja do atmosfery licznych radioaktywnych nuklidów, wśród których znajdowały się jod-131, cez-134, cez-137 oraz stront-90. Ostatni z wymienionych wykazuje wysokie podobieństwo chemiczne wobec jednego z pierwiastków budujących tkankę kostną. W efekcie stront może wbudowywać się w kości i pozostając w nich – przez wiele lat emitować promieniowanie β–.
Na podstawie: P. Atkins, L. Jones, Chemia ogólna. Cząsteczki, materia, reakcje, Warszawa 2018.
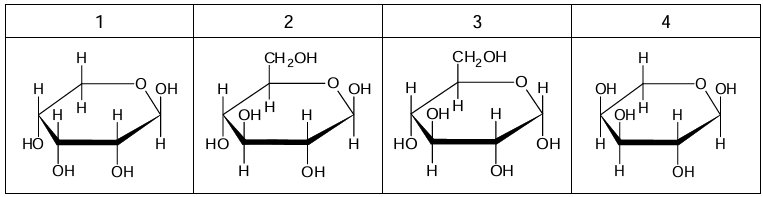
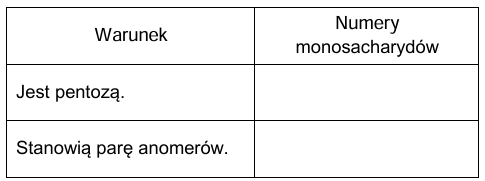
Podkreśl właściwe wyrażenia w nawiasach, aby powstały zdania prawdziwe.
Nuklidem o największej liczbie neutronów w jądrze atomowym jest (131I / 134Cs / 137Cs / 90Sr), natomiast najmniejszą liczbę takich cząstek zawiera (131I / 134Cs / 137Cs / 90Sr). Atomy jodu-131 (łatwiej / trudniej) przechodzą w postać kationu niż atomy strontu-90, a promień atomu cezu-137 jest (większy / mniejszy) od promienia atomu strontu-90. Można zatem wnioskować, że atomy cezu-137 są (silniejszym / słabszym) reduktorem niż atomy strontu-90 i jednocześnie są (silniejszym / słabszym) reduktorem niż atomy jodu-131.
© dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone