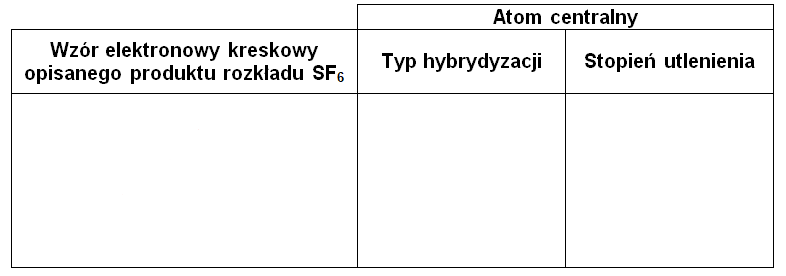
W wodnych roztworach, między stałymi – dysocjacji zasadowej (Kb) zasady Brønsteda oraz stałą dysocjacji kwasowej (Ka) sprzężonego z nią kwasu istnieje relacja zwana iloczynem jonowym wody (Kw), który w temperaturze 298 K ma wartość 10–14:
Kw = Ka∙Kb
Jeśli do wodnego roztworu wprowadzona zostanie sól zawierająca określony wodoroanion, możliwe jest wówczas ustalenie, czy taki jon w wodnym roztworze łatwiej ulega dysocjacji kwasowej – odszczepia proton, czy dysocjacji zasadowej, stanowiąc wtedy jego akceptor.
Na podstawie: A. Hulanicki, Reakcje kwasów i zasad w chemii analitycznej, Warszawa 2016.
W temperaturze 298 K do zlewki zawierającej 200 cm3 wodnego roztworu wodorotlenku sodu o stężeniu 0,1 mol∙dm–3 wprowadzono 100 cm3 roztworu kwasu fosforowego(V) o takim samym stężeniu molowym oraz tej samej temperaturze, jak roztwór wodorotlenku.
Woda ulega procesowi autodysocjacji, dlatego w każdym wodnym roztworze ustala się równowaga, którą w temperaturze 298 K opisuje iloczyn jonowy wody o wartości 10–14:
H2O + H2O ⇄ OH– + H3O+
Z równowagi tej wynika, że w ujęciu teorii Brønsteda-Lowry’ego proces zobojętniania kwasu zasadą jest reakcją odwrotną względem autodysocjacji wody.
Po wprowadzeniu roztworu kwasu fosforowego(V) do roztworu zasady i dokładnym wymieszaniu zawartości naczynia stwierdzono, że temperatura uzyskanego roztworu była wyższa niż 298 K.
Spośród podanych poniżej dwóch wartości iloczynu jonowego wody wybierz podkreślając tę, która odpowiada temperaturze wyższej niż 298 K. Uzasadnij wybór.
0,1∙10–14 3,0∙10–14
Uzasadnienie:
© dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone