Wskazanie typu oraz mechanizmów reakcji chemicznych. Zadanie 18. Arkusz CKE chemia maj 2025 rozszerzony (1 punkt)
Poniżej przedstawiono wzór 1,4-dimetylobenzenu, czyli p-ksylenu.
Ten związek reaguje z bromem zarówno pod wpływem światła, jak i w obecności żelaza.
Na podstawie: J. McMurry, Chemia organiczna, Warszawa 2018.
Uzupełnij tabelę. Napisz nazwę typu reakcji p-ksylenu z bromem pod wpływem światła i w obecności żelaza (addycja, eliminacja albo substytucja) oraz nazwę mechanizmu (elektrofilowy, nukleofilowy albo rodnikowy), według którego przebiega każda z tych reakcji.
Zapis równania reakcji monobromowania p-ksylenu pod wpływem światła. Zadanie 19. Arkusz CKE chemia maj 2025 rozszerzony (1 punkt)
Poniżej przedstawiono wzór 1,4-dimetylobenzenu, czyli p-ksylenu.

Ten związek reaguje z bromem zarówno pod wpływem światła, jak i w obecności żelaza.
Na podstawie: J. McMurry, Chemia organiczna, Warszawa 2018.
Napisz równanie reakcji monobromowania p-ksylenu pod wpływem światła. Zastosuj wzory półstrukturalne (grupowe) związków organicznych.
Zapis wzoru grupowego właściwego kwasu karboksylowego. Zadanie 20. Arkusz CKE chemia maj 2025 rozszerzony (1 punkt)
Poniżej przedstawiono wzór 1,4-dimetylobenzenu, czyli p-ksylenu.

Ten związek reaguje z bromem zarówno pod wpływem światła, jak i w obecności żelaza.
Na podstawie: J. McMurry, Chemia organiczna, Warszawa 2018.
W wyniku katalitycznego utlenienia p-ksylenu otrzymuje się kwas tereftalowy, czyli kwas benzeno-1,4-dikarboksylowy.
Napisz wzór półstrukturalny (grupowy) lub uproszczony opisanego kwasu.
Uzupełnienie schematu reakcji otrzymywania alkoholu. Zadanie 21. Arkusz CKE chemia maj 2025 rozszerzony (1 punkt)
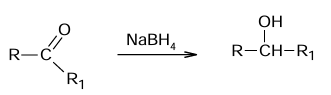
Borowodorek sodu o wzorze NaBH4 jest odczynnikiem stosowanym w chemii organicznej. Ten związek selektywnie i z dużą wydajnością redukuje grupy karbonylowe w aldehydach i w ketonach do grup hydroksylowych, natomiast nie redukuje grup karboksylowych ani estrowych. Schemat redukcji grupy karbonylowej przedstawiono poniżej.
Na podstawie: L.G. Wade, Organic chemistry, Pearson Ed. 2006.
Uzupełnij schemat reakcji otrzymywania 2,2-dimetylopropan-1-olu opisaną metodą. Zastosuj wzory półstrukturalne (grupowe) związków organicznych.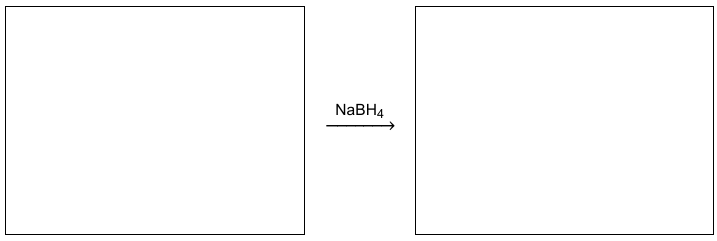
Rozstrzygnięcie z uzasadnieniem, w której reakcji uzyskano racemat. Zadanie 22. Arkusz CKE chemia maj 2025 rozszerzony (1 punkt)
Borowodorek sodu o wzorze NaBH4 jest odczynnikiem stosowanym w chemii organicznej. Ten związek selektywnie i z dużą wydajnością redukuje grupy karbonylowe w aldehydach i w ketonach do grup hydroksylowych, natomiast nie redukuje grup karboksylowych ani estrowych. Schemat redukcji grupy karbonylowej przedstawiono poniżej.

Na podstawie: L.G. Wade, Organic chemistry, Pearson Ed. 2006.
Przeprowadzono dwie reakcje: propan-2-onu oraz butan-2-onu – każda z borowodorkiem sodu. W jednej z tych przemian otrzymano mieszaninę enancjomerów.
Rozstrzygnij, w której reakcji – z propan-2-onem czy z butan-2-onem – otrzymano mieszaninę enancjomerów. Odpowiedź uzasadnij. Rozstrzygnięcie: Uzasadnienie:
Szeregowanie estrów według wzrastającej temperatury wrzenia. Zadanie 24. Arkusz CKE chemia maj 2025 rozszerzony (1 punkt)
Poniżej podano wzory trzech estrów.
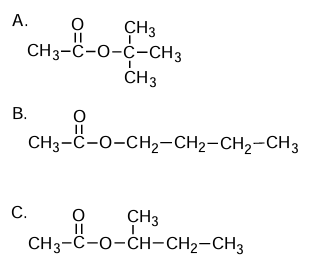
Uszereguj podane estry zgodnie ze wzrostem ich temperatur wrzenia. Użyj oznaczeń literowych (A–C).![]()
Uzupełnienie schematu enancjomerami kwasu mlekowego. Zadanie 25.1. Arkusz CKE chemia maj 2025 rozszerzony (1 punkt)
Poli(kwas mlekowy), oznaczany symbolem PLA, jest biodegradowalnym termoplastycznym poliestrem wytwarzanym z surowców naturalnych. Można go otrzymać w reakcji polikondensacji kwasu mlekowego (kwasu 2-hydroksypropanowego).
Uzupełnij poniższy schemat tak, aby przedstawiał on wzory obu enancjomerów kwasu mlekowego.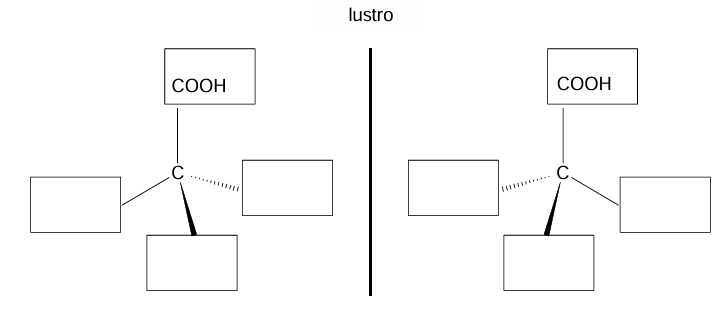
Rysowanie wzoru grupowego poli(kwasu mlekowego). Zadanie 25.2. Arkusz CKE chemia maj 2025 rozszerzony (1 punkt)
Poli(kwas mlekowy), oznaczany symbolem PLA, jest biodegradowalnym termoplastycznym poliestrem wytwarzanym z surowców naturalnych. Można go otrzymać w reakcji polikondensacji kwasu mlekowego (kwasu 2-hydroksypropanowego).
Napisz wzór półstrukturalny (grupowy) poli(kwasu mlekowego).
Rozstrzygnięcie do której probówki wprowadzono kwas mlekowy. Zadanie 26. Arkusz CKE chemia maj 2025 rozszerzony (1 punkt)
W celu zidentyfikowania wodnych roztworów trzech substancji: glicerolu (propano-1,2,3-triolu), kwasu mlekowego (kwasu 2-hydroksypropanowego) i alanyloglicyloalaniny, przeprowadzono doświadczenie. W trzech probówkach I–III przygotowano świeżo strącony wodorotlenek miedzi(II) i do każdej z nich wprowadzono po jednym z badanych roztworów w nadmiarze. Probówki, wraz z zawartością, energicznie wstrząśnięto i we wszystkich zaobserwowano roztworzenie wodorotlenku miedzi(II). Na poniższych zdjęciach przedstawiono zawartości probówek po zakończeniu doświadczenia.

Rozstrzygnij, do której probówki (I, II albo III) wprowadzono roztwór kwasu mlekowego. Napisz w formie cząsteczkowej równanie reakcji, która zaszła w tej probówce podczas opisanego doświadczenia. Rozstrzygnięcie: Równanie reakcji:
Ocena poprawności zdań dotyczących oktopaminy. Zadanie 27.1. Arkusz CKE chemia maj 2025 rozszerzony (1 punkt)
Oktopamina jest hormonem występującym w organizmach bezkręgowców. Jej wzór przedstawiono poniżej.
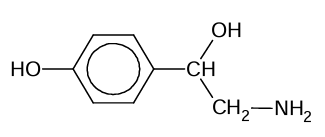
Oceń prawdziwość zdań. Zaznacz P, jeśli zdanie jest prawdziwe, albo F – jeśli jest fałszywe. 1. Grupy –OH w cząsteczce oktopaminy różnią się zdolnością odłączania protonu. 2. Oktopamina może być utleniona do ketonu.
Wybór właściwych wyrażeń w nawiasach dotyczących oktopaminy. Zadanie 27.2. Arkusz CKE chemia maj 2025 rozszerzony (1 punkt)
Oktopamina jest hormonem występującym w organizmach bezkręgowców. Jej wzór przedstawiono poniżej.

We wzorze cząsteczki oktopaminy literami A–C zaznaczono wybrane fragmenty jej struktury.
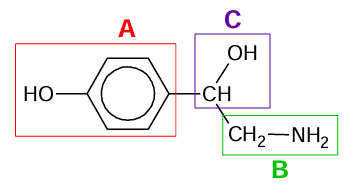
W temperaturze 25 oC przeprowadzono doświadczenie. Do dwóch probówek zawierających oktopaminę wprowadzono: do jednej rozcieńczony kwas solny, a do drugiej wodny roztwór chlorku żelaza(III).
Uzupełnij zdania. Zaznacz jedną odpowiedź spośród podanych w każdym nawiasie. Rozcieńczony kwas solny uległ reakcji z fragmentem struktury oktopaminy oznaczonym literą (A / B / C). Fragment struktury oktopaminy oznaczony literą A (uległ / nie uległ) reakcji z chlorkiem żelaza(III).
Uzupełnienie schematu wzorami odpowiednich substancji. Zadanie 27.3. Arkusz CKE chemia maj 2025 rozszerzony (1 punkt)
Oktopamina jest hormonem występującym w organizmach bezkręgowców. Jej wzór przedstawiono poniżej.

Próbkę oktopaminy wprowadzono do zakwaszonego roztworu azotanu(III) potasu. W wyniku reakcji wydzielił się bezbarwny, niepalny gaz o masie molowej równej 28 g ∙ mol–1. Otrzymany w warunkach doświadczenia organiczny produkt X opisanej reakcji – wprowadzony do probówki zawierającej świeżo strącony osad wodorotlenku miedzi(II) i nadmiar zasady – spowodował roztworzenie osadu i powstanie klarownego roztworu barwy ciemnoniebieskiej (szafirowej).
Uzupełnij schemat tak, aby powstało w formie jonowej skróconej równanie reakcji, w której otrzymano organiczny produkt X. Napisz wzory brakujących produktów.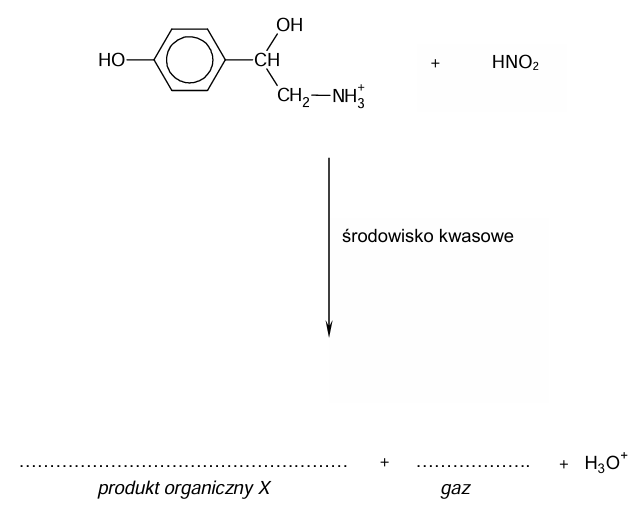
Zapis równania reakcji chemicznej. Zadanie 28.1. Arkusz CKE chemia maj 2025 rozszerzony (1 punkt)
W jednej z metod syntezy 𝛼-aminokwasów pierwszym etapem jest reakcja kwasu karboksylowego z bromem. W obecności fosforu i w odpowiednich warunkach jeden z atomów wodoru przy atomie węgla 𝛼 w cząsteczce kwasu jest zastępowany przez atom bromu. W drugim etapie, pod działaniem stężonego wodnego roztworu amoniaku, następuje wymiana atomu bromu na grupę aminową. W efekcie powstaje sól amonowa odpowiedniego aminokwasu.
Przeprowadzono ciąg przemian, w wyniku których z kwasu propanowego (propionowego) powstał związek B.

Napisz w formie cząsteczkowej równanie reakcji 1. Zastosuj wzory półstrukturalne (grupowe) związków organicznych.
Zapis jonowego równania reakcji chemicznej. Zadanie 28.2. Arkusz CKE chemia maj 2025 rozszerzony (1 punkt)
W jednej z metod syntezy 𝛼-aminokwasów pierwszym etapem jest reakcja kwasu karboksylowego z bromem. W obecności fosforu i w odpowiednich warunkach jeden z atomów wodoru przy atomie węgla 𝛼 w cząsteczce kwasu jest zastępowany przez atom bromu. W drugim etapie, pod działaniem stężonego wodnego roztworu amoniaku, następuje wymiana atomu bromu na grupę aminową. W efekcie powstaje sól amonowa odpowiedniego aminokwasu.
Przeprowadzono ciąg przemian, w wyniku których z kwasu propanowego (propionowego) powstał związek B.

Związek A reaguje z amoniakiem w stosunku molowym 𝑛A ∶ 𝑛NH3 = 1 ∶ 3 (reakcja 2.).
Napisz w formie jonowej równanie reakcji 2.