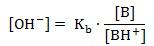Zadanie 4. Arkusz Palladium kwiecień 2019 (1 punkt)
Atomy technetu zawierające 54 neutrony można uzyskać w wyniku bombardowania deuterem atomów jednego z izotopów pewnego pierwiastka chemicznego, zawierającego 42 elektrony oraz liczbę neutronów równą liczbie dodatnich ładunków znajdujących się w jądrze atomu cezu.
Uzupełnij poniższy schemat, aby przedstawiał równanie opisanej reakcji jądrowej. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone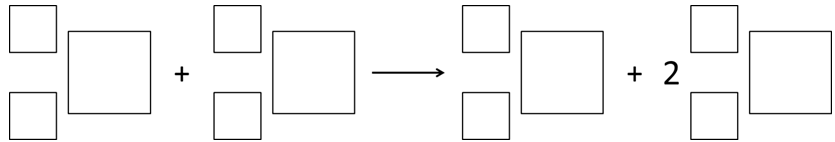
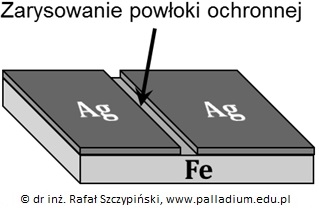
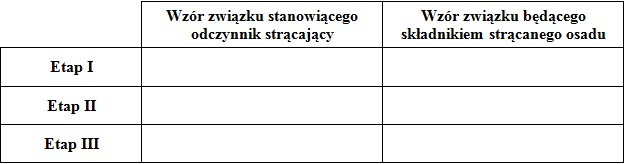
Zadanie 5. Arkusz Palladium kwiecień 2019 (1 punkt)
W zlewce znajdował się wodny roztwór zawierający mieszaninę trzech soli – octanów, w którym stężenia jonów Mg2+ oraz Zn2+ były identyczne i wynosiły po 0,02 mol∙dm-3. Stężenie jonów Ag+ natomiast było równe 0,005 mol∙dm-3. Do opisanego układu wprowadzono kilka kropli alkoholowego roztworu fenoloftaleiny.
Ustal na podstawie stosownych obliczeń stężenie molowe jonów octanowych, znajdujących się w roztworze. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone