Obliczanie stężenia molowego jonów chlorkowych w roztworze powstałym z udziałem hydratu chlorku żelaza(III)
W temperaturze 20 oC rozpuszczalność sześciowodnego chlorku żelaza(III) ma wartość 395 g/ 100g wody.
Na podstawie: W. Mizerski, Tablice chemiczne, Warszawa 2013.
W zlewce z wodą destylowaną rozpuszczono taką ilość opisanego hydratu chlorku żelaza(III), że uzyskano 25 g nasyconego w temperaturze 20 oC roztworu soli bezwodnej. Następnie w kolbie miarowej o pojemności 50 cm3 umieszczono 10 g opisanego roztworu i uzupełniono wodą destylowaną „do kreski”, a do pozostałej w zlewce substancji dodano 100 cm3 wody destylowanej.
Oblicz stężenie molowe jonów chlorkowych w docelowym roztworze, jaki znajdował się w kolbie miarowej. Wynik podaj z dokładnością do trzech cyfr znaczących © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie procentu wagowego jonów żelaza(III) w roztworze uzyskanym z wykorzystaniem hydratu chlorku żelaza(III)
W temperaturze 20 oC rozpuszczalność sześciowodnego chlorku żelaza(III) ma wartość 395 g/ 100g wody.
Na podstawie: W. Mizerski, Tablice chemiczne, Warszawa 2013.
W zlewce z wodą destylowaną rozpuszczono taką ilość opisanego hydratu chlorku żelaza(III), że uzyskano 25 g nasyconego w temperaturze 20 oC roztworu soli bezwodnej. Następnie w kolbie miarowej o pojemności 50 cm3 umieszczono 10 g opisanego roztworu i uzupełniono wodą destylowaną „do kreski”, a do pozostałej w zlewce substancji dodano 100 cm3 wody destylowanej.
Oblicz, jaki procent masy znajdującego się w zlewce docelowego roztworu stanowiły jony żelaza(III)? Wynik podaj z dokładnością do drugiego miejsca po przecinku. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie masy pozostałego roztworu po odparowaniu wody oraz wykrystalizowaniu hydratu
Hydrat o wzorze CuSO4·5H2O w temperaturze 40 oC ma rozpuszczalność 53,2 g/100 g wody. Przygotowano 200 g nasyconego w 40 oC roztworu soli bezwodnej. Po pewnym czasie stwierdzono, że w opisanych warunkach temperaturowych masa zawartości naczynia zmalała o 10 g, a na jego dnie pojawiły się kryształki opisanego hydratu, które odsączono.
Oblicz masę roztworu pozostałego po odsączeniu wykrystalizowanego hydratu. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zapis równania reakcji roztwarzania miedzi w roztworze zawierającym jony żelaza(III)
Metaliczna miedź może zostać roztworzona za pomocą wodnych roztworów niektórych związków chemicznych. Jeśli do przeprowadzenia opisanego procesu wykorzysta się roztwór chlorku żelaza(III), w układzie pojawiają się wówczas dwa rodzaje kationów. Elektrony opisane orbitalami d jednego z nich stanowią 2/3 liczby elektronów opisanych orbitalami d drugiego z powstałych jonów.
Napisz w formie jonowej skróconej równanie opisanej reakcji chemicznej oraz określ, jaką barwę przyjmie roztwór po jej zakończeniu? © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
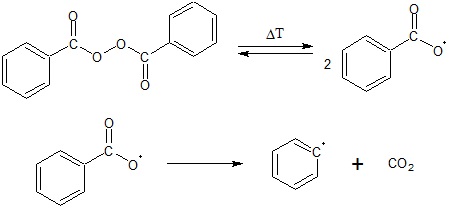
Wyjaśnienie różnic w temperaturach wrzenia kwasu karboksylowego i alkoholu względem aldehydu
W tabeli zebrano informacje na temat wybranych jednofunkcyjnych pochodnych alkanów o prostych łańcuchach węglowych. W kolumnie A podano ich masy molowe, a w kolumnie B odpowiadające im temperatury wrzenia (⁰C) pod ciśnieniem 1013 hPa.
Na podstawie: W. Mizerski, Tablice chemiczne, Warszawa 2013.
Podaj przyczynę tak dużych różnic w wartościach temperatur wrzenia alkoholu oraz kwasu karboksylowego, w porównaniu z aldehydem o zbliżonej do nich masie molowej. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Wyjaśnienie różnic w temperaturach wrzenia kwasu karboksylowego oraz alkoholu
W tabeli zebrano informacje na temat wybranych jednofunkcyjnych pochodnych alkanów o prostych łańcuchach węglowych. W kolumnie A podano ich masy molowe, a w kolumnie B odpowiadające im temperatury wrzenia (⁰C) pod ciśnieniem 1013 hPa.

Na podstawie: W. Mizerski, Tablice chemiczne, Warszawa 2013.
Wyjaśnij, dlaczego temperatura wrzenia kwasu karboksylowego jest wyższa od temperatury wrzenia alkoholu o identycznej masie molowej? © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Określanie kolejności zmiany stanu skupienia przez związki organiczne
W tabeli zebrano informacje na temat wybranych jednofunkcyjnych pochodnych alkanów o prostych łańcuchach węglowych. W kolumnie A podano ich masy molowe, a w kolumnie B odpowiadające im temperatury wrzenia (⁰C) pod ciśnieniem 1013 hPa.

Na podstawie: W. Mizerski, Tablice chemiczne, Warszawa 2013.
W czterech parownicach umieszczono próbki (po 5 ml każda) metanolu, kwasu mrówkowego, propanalu oraz etanolu i ostrożnie ogrzewano na łaźni olejowej.
W jakiej kolejności swój stan skupienia zmienią poszczególne związki chemiczne? © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Określanie wzoru sumarycznego hydratu jodku sodu na podstawie jego rozpuszczalności oraz soli bezwodnej
W temperaturze 20 oC wyrażona w g/100 g wody rozpuszczalność pewnego hydratu jodku sodu oraz soli bezwodnej wynoszą odpowiednio 383 g oraz 177,4 g. W tej samej temperaturze nasycone roztwory wodne uzyskane w wyniku rozpuszczenia hydratu lub jego soli bezwodnej charakteryzują się identyczną wartością stężenia procentowego.
Na podstawie: W. Mizerski, Tablice chemiczne, Warszawa 2013 oraz R. Szczypiński, Projektowanie doświadczeń chemicznych. Dla maturzystów i nie tylko, Warszawa 2019.
Wykonując niezbędne obliczenia ustal wzór sumaryczny opisanego w informacji wprowadzającej hydratu jodku sodu. Rozwiązanie tego zadania dostępne jest nieodpłatnie pod poniższym linkiem: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Określanie równania kinetycznego reakcji utleniania jonów jodkowych jonami nadtlenodisiarczanowymi
Proces utleniania jonów jodkowych jonami nadtlenodisiarczanowymi przebiega w środowisku wodnym zgodnie z równaniem stechiometrycznym:
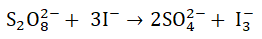
Na podstawie: P. W. Atkins, L. Jones, Chemia ogólna. Cząsteczki, materia, reakcje, Warszawa 2018.
Podczas wyznaczania rzędowości opisanej reakcji chemicznej względem każdego z substratów stwierdzono, że w wyniku dwukrotnego zwiększenia stężenia jonów jodkowych (przy stałym stężeniu jonów S2O82–) szybkość reakcji wzrasta dwukrotnie. Zmniejszając dwukrotnie stężenie jonów S2O82– (przy stałym stężeniu jonów jodkowych) szybkość reakcji utleniania jonów jodkowych dwukrotnie maleje.
Napisz równanie kinetyczne opisanego procesu. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
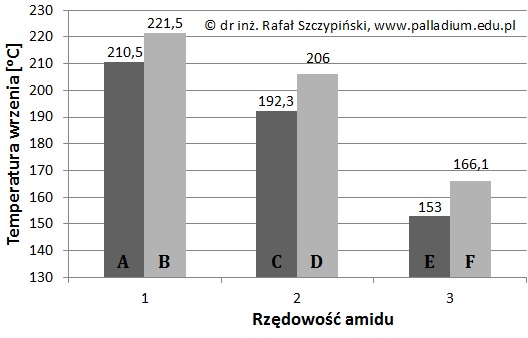
Wyjaśnienie przyczyny spadku temperatury wrzenia amidów wraz ze wzrostem ich rzędowości
Temperatura wrzenia amidów jest ściśle powiązana z budową ich cząsteczek. Na poniższym diagramie litery A÷F oznaczają pewne amidy różniące się liczbą atomów węgla w cząsteczce oraz rzędowością. Są to w losowej kolejności wymienione związki chemiczne o nazwach: etanoamid, N,N-dimetylometanoamid, N-metyloetanoamid, metanoamid, N,N-dimetyloetanoamid, , N-metylometanoamid.
Na podstawie: W. Mizerski, Tablice chemiczne, Warszawa 2013.
Wyjaśnij, dlaczego temperatury wrzenia amidów zwykle maleją wraz ze wzrostem ich rzędowości? © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone