Ocena poprawności stwierdzeń dotyczących reakcji z roztworem związku kompleksowego cynku
Wodorotlenki trudno rozpuszczalne w wodzie można otrzymać w reakcji roztworów niektórych związków kompleksowych z kwasami. Przykładem może być działanie kwasem solnym na wodny roztwór tetrahydroksocynkanu potasu. Stosując nadmiar roztworu kwasu spowodujemy dalszy przebieg reakcji chemicznej, co poskutkuje roztworzeniem się osadu powstałego wodorotlenku.
Oceń poprawność poniższych zdań wpisując literę „P” (prawda) lub literę „F” (fałsz). 1. Podczas reakcji roztworu związku kompleksowego z kwasem wartość pH układu reakcyjnego nie zmienia się. 2. W wyniku opisanego procesu cynk zmienia swój stopień utlenienia. 3. Zwiększając stopniowo pH roztworu zawierającego jony Zn2+ można otrzymać roztwór związku kompleksowego zawierającego cynk. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Określanie barwy roztworu uzyskanego po wprowadzeniu gazowego chlorowodoru do wody w obecności oranżu metylowego
Do 1 dm3 wody zawierającej dodatek kilku kropli roztworu oranżu metylowego wprowadzono 560 cm3 chlorowodoru (odmierzonego w warunkach normalnych) i zaobserwowano zmianę zabarwienia zawartości naczynia. Następnie do uzyskanego roztworu wprowadzono 962 mg wapna gaszonego i energicznie wstrząśnięto zawartością naczynia reakcyjnego.
Określ barwę roztworu uzyskanego po wprowadzeniu chlorowodoru do opisanego wodnego roztworu zawierającego oranż metylowy. Odpowiedź uzasadnij równaniem odpowiedniego procesu zapisanym w formie jonowej skróconej. Barwa roztworu: Równanie procesu: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Opis obserwacji podczas wprowadzenia wapna gaszonego do kwasu solnego w obecności oranżu metylowego
Do 1 dm3 wody zawierającej dodatek kilku kropli roztworu oranżu metylowego wprowadzono 560 cm3 chlorowodoru (odmierzonego w warunkach normalnych) i zaobserwowano zmianę zabarwienia zawartości naczynia. Następnie do uzyskanego roztworu wprowadzono 962 mg wapna gaszonego i energicznie wstrząśnięto zawartością naczynia reakcyjnego.
Wykonaj niezbędne obliczenia i napisz, co zaobserwowano po wprowadzeniu wapna gaszonego do opisanego roztworu kwasu solnego oraz jaki był odczyn docelowego roztworu? Obserwacje: Odczyn roztworu: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Określanie odczynu roztworu uzyskanego w wyniku reakcji roztworu wodorotlenku wapnia i kwasu solnego
Pewien doktorant przygotował trzy odważki substancji, które umieścił w kolbach miarowych i uzupełnił wodą do maksimum ich pojemności. Chlorowodorem nasycił znajdującą się w czwartej kolbie wodę. Pojemność każdego z naczyń wynosiła 1 dm3. Ilości wszystkich substancji odmierzył w temperaturze 20 ⁰C, pod ciśnieniem 1013 hPa. Dane zestawił w postaci tabeli*.
*Wartości rozpuszczalności pochodzą z Tablic chemicznych W. Mizerskiego, Warszawa 2013.
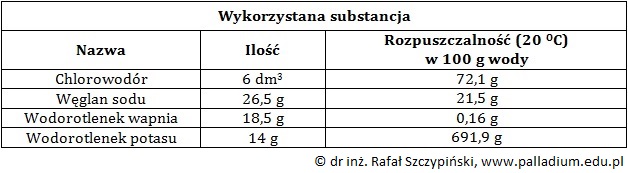
Po dokładnym wymieszaniu zawartości kolby, w której znajdowała się mieszanina wodorotlenku wapnia z wodą, doktorant pobrał 10 cm3 próbki i zmieszał z taką samą objętością roztworu pobranego z kolby, z rozpuszczonym w wodzie chlorowodorem. Do mieszaniny poreakcyjnej dodał dwie krople roztworu lakmusu.
Określ, jaką barwę przyjął roztwór po zakończeniu doświadczenia? Odpowiedź uzasadnij obliczeniami. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie masy benzenu zawierającej określoną masę węgla
Benzen jest węglowodorem o wzorze sumarycznym C6H6.
Oblicz masę próbki benzenu zawierającej 0,3 g węgla oraz określ masę znajdującego się w niej wodoru. Wyniki podaj w miligramach, stosując przybliżenie do cyfry jedności. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Określanie liczby atomów wodoru znajdujących się w określonej masie benzenu
Benzen jest węglowodorem o wzorze sumarycznym C6H6.
Oblicz, jaka liczba atomów wodoru znajduje się w 19,5 mg benzenu? © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie liczby cząsteczek toluenu, w której znajduje się określona łączna liczba atomów węgla i wodoru
Toluen jest węglowodorem o wzorze sumarycznym C7H8. W temperaturze 298 K pod ciśnieniem normalnym ma ciekły stan skupienia oraz gęstość 0,86 g·cm–3.
Oblicz, w jakiej liczbie cząsteczek toluenu znajduje się łącznie 4,5∙1023 atomów węgla i wodoru, a następnie określ objętość tej próbki w centymetrach sześciennych, stosując przybliżenie do trzech cyfr znaczących. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Określanie mas próbek zawierających określone liczby moli indywiduów chemicznych
Dane są następujące próbki substancji o określonych liczbach indywiduów chemicznych: 2 mole cząsteczek siarkowodoru (H2S) oraz 0,08 mola atomów niklu.
Oblicz masę każdej z wymienionych próbek. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone

