Zadanie 21.1. Zapis równania reakcji chemicznej z udziałem wybranego odczynnika. Doświadczenia chemiczne w zadaniach część 1. Rozdział 5 (1 punkt)
Przeprowadzono doświadczenie chemiczne według zamieszczonego schematu:

Celem tego eksperymentu było ustalenie, który z kwasów – krzemowy (H2SiO3), czy octowy jest mocniejszy. W probówce 1. znajdował się silnie alkaliczny, wodny roztwór pewnej substancji, do którego wprowadzono stechiometryczną ilość odczynnika X, wybranego spośród następujących:
CH3COONa(aq), K2CO3(aq), CH3COOH(c), K2SiO3(aq).
Wybierz właściwy odczynnik X wykorzystany podczas tego doświadczenia. Odpowiedź uzasadnij jonowym równaniem reakcji chemicznej jaka przebiegła. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zadanie 21.2. Zapis równania właściwego procesu chemicznego. Doświadczenia chemiczne w zadaniach część 1. Rozdział 5 (1 punkt)
Przeprowadzono doświadczenie chemiczne według zamieszczonego schematu:

Celem tego eksperymentu było ustalenie, który z kwasów – krzemowy (H2SiO3), czy octowy jest mocniejszy. W probówce 1. znajdował się silnie alkaliczny, wodny roztwór pewnej substancji, do którego wprowadzono stechiometryczną ilość odczynnika X, wybranego spośród następujących:
CH3COONa(aq), K2CO3(aq), CH3COOH(c), K2SiO3(aq).
Odczynnik Y wprowadzony do 2. probówki stanowił alkoholowy roztwór fenoloftaleiny. Po wykonaniu tej czynności zawartością naczynia energicznie wstrząśnięto.
Napisz równanie chemiczne procesu, którego przebieg doprowadził do pojawienia się widocznego na fotografii 3. zabarwienia. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zadanie 22.1. Zapis równania chemicznego zgodnie z teorią Brønsteda-Lowry’ego. Doświadczenia chemiczne w zadaniach część 1. Rozdział 5 (1 punkt)
Do wodnego roztworu benzoesanu potasu wprowadzono 10-procentowy kwas solny. Efekt przeprowadzonego doświadczenia przedstawia zamieszczona fotografia.

Stosując teorię protonową kwasów oraz zasad Brønsteda-Lowry’ego napisz w formie jonowej skróconej równanie reakcji chemicznej jaka przebiegła. Zastosuj wzory grupowe lub uproszczone odpowiednich drobin (cząsteczek, jonów). © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zadanie 22.2. Zapis dwóch wniosków dotyczących kwasu benzoesowego. Doświadczenia chemiczne w zadaniach część 1. Rozdział 5 (1 punkt)
Do wodnego roztworu benzoesanu potasu wprowadzono 10-procentowy kwas solny. Efekt przeprowadzonego doświadczenia przedstawia zamieszczona fotografia.

Zapisz dwa wnioski dotyczące kwasu benzoesowego jakie wynikają z przebiegu opisanego doświadczenia chemicznego. 1.: 2.: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zadanie 23. Wybór właściwej probówki oraz zapis równania reakcji chemicznej. Doświadczenia chemiczne w zadaniach część 1. Rozdział 5 (1 punkt)
Blaszkę miedzianą poddano działaniu gorącego roztworu nadtlenku wodoru w środowisku lekko kwasowym. Po zakończeniu ogrzewania blaszkę usunięto i wypłukano, a następnie sfotografowano (zdjęcie A). Uzyskaną w ten sposób blaszkę umieszczono w probówce z roztworem kwasu mrówkowego. Po pewnym czasie przyjęła ona wygląd przedstawiony na fotografii B.

Spośród zamieszczonych fotografii 1.–3. wybierz tę, która przedstawia zawartość probówki uzyskaną po usunięciu z niej blaszki przedstawionej na zdjęciu B. Odpowiedź uzasadnij równaniem reakcji chemicznej jaka przebiegła. Numer probówki: Równanie reakcji: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zadanie 24.1. Zapis równania reakcji z udziałem kwasu octowego. Doświadczenia chemiczne w zadaniach część 1. Rozdział 5 (1 punkt)
Zamieszczony rysunek przedstawia wzór Fischera cząsteczki kwasu L(+) winowego.
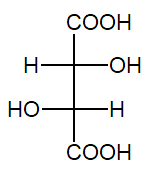
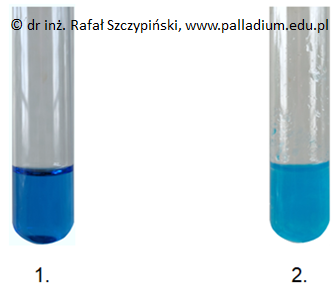
W dwóch niepodpisanych probówkach znajdowały się wodne roztwory kwasu L(+) winowego oraz kwasu octowego. W celu ich odróżnienia przeprowadzono dwuetapowe doświadczenie chemiczne. Próbki wymienionych mieszanin wprowadzono do probówek zawierających zasadę potasową (etap I). W tak uzyskanych roztworach umieszczono alkaliczne zawiesiny wodorotlenku miedzi(II), a następnie zawartością każdego z naczyń energicznie wstrząśnięto (etap II). Fotografie 1.–2. przedstawiają efekt przeprowadzonego eksperymentu.
Napisz równanie reakcji chemicznej, jaka przebiegła w pierwszym etapie doświadczenia z udziałem kwasu octowego. Zastosuj wzory półstrukturalne (grupowe) odpowiednich związków chemicznych. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zadanie 24.2. Przypisywanie nazw kwasów do zawartości odpowiednich naczyń oraz wyjaśnienie. Doświadczenia chemiczne w zadaniach część 1. Rozdział 5 (2 punkty)
Zamieszczony rysunek przedstawia wzór Fischera cząsteczki kwasu L(+) winowego.

W dwóch niepodpisanych probówkach znajdowały się wodne roztwory kwasu L(+) winowego oraz kwasu octowego. W celu ich odróżnienia przeprowadzono dwuetapowe doświadczenie chemiczne. Próbki wymienionych mieszanin wprowadzono do probówek zawierających zasadę potasową (etap I). W tak uzyskanych roztworach umieszczono alkaliczne zawiesiny wodorotlenku miedzi(II), a następnie zawartością każdego z naczyń energicznie wstrząśnięto (etap II). Fotografie 1.–2. przedstawiają efekt przeprowadzonego eksperymentu.

Numerom probówek 1. oraz 2. na zamieszczonych fotografiach przypisz nazwy znajdujących się w nich przed rozpoczęciem doświadczenia roztworów kwasów. Wyjaśnij przyczynę różnicy w wyglądzie zawartości tych naczyń. Odnieś się do budowy określonych drobin (cząsteczek, jonów). Probówka 1.: Probówka 2.: Wyjaśnienie: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zadanie 25.1. Rysowanie wzoru uproszczonego związku chemicznego zidentyfikowanego w pierwszym etapie eksperymentu. Doświadczenia chemiczne w zadaniach część 1. Rozdział 5 (1 punkt)
W opakowaniach pozbawionych etykiet znajdowały się trzy kwasy karboksylowe – salicylowy, benzoesowy oraz acetylosalicylowy. W celu ich odróżnienia przeprowadzono dwuetapowe doświadczenie chemiczne.
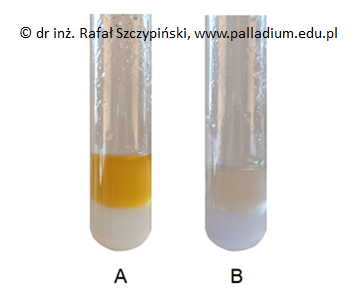
I etap: próbkę każdej z wymienionych substancji wprowadzono do probówek zawierających roztwór chlorku żelaza(III) i energicznie wstrząśnięto. Fotografie 1.–3. przedstawiają zawartość opisanych naczyń po zakończeniu tego etapu eksperymentu.

II etap: zawartość 1. oraz 3. probówki zakwaszono stosując kwas solny. Fotografia A przedstawia efekt zaobserwowany po kilkunastu minutach od momentu zakwaszenia zawartości 1. probówki. W probówce 3. praktycznie nie zaobserwowano żadnych zmian.
Narysuj wzór grupowy lub uproszczony cząsteczki kwasu zidentyfikowanego w I etapie przeprowadzonego doświadczenia. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zadanie 25.2. Wyjaśnienie przyczyny zmiany barwy oraz rysowanie wzoru grupowego. Doświadczenia chemiczne w zadaniach część 1. Rozdział 5 (2 punkty)
W opakowaniach pozbawionych etykiet znajdowały się trzy kwasy karboksylowe – salicylowy, benzoesowy oraz acetylosalicylowy. W celu ich odróżnienia przeprowadzono dwuetapowe doświadczenie chemiczne.
I etap: próbkę każdej z wymienionych substancji wprowadzono do probówek zawierających roztwór chlorku żelaza(III) i energicznie wstrząśnięto. Fotografie 1.–3. przedstawiają zawartość opisanych naczyń po zakończeniu tego etapu eksperymentu.

II etap: zawartość 1. oraz 3. probówki zakwaszono stosując kwas solny. Fotografia A przedstawia efekt zaobserwowany po kilkunastu minutach od momentu zakwaszenia zawartości 1. probówki. W probówce 3. praktycznie nie zaobserwowano żadnych zmian.
Wyjaśnij, dlaczego w drugim etapie eksperymentu nastąpiła zmiana barwy roztworu znajdującego się w 1. probówce. Narysuj wzór grupowy lub uproszczony kwasu, jaki znajdował się w tym naczyniu w momencie rozpoczęcia doświadczenia. Uzupełnij tabelę. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zadanie 26.1. Zapis wniosku dotyczącego rozpuszczalności bromu. Doświadczenia chemiczne w zadaniach część 1. Rozdział 5 (1 punkt)
Zbadano zachowanie się benzenu oraz N-fenyloaniliny wobec wody bromowej w dwuetapowym doświadczeniu. W pierwszym etapie do probówki z wymienionym odczynnikiem wprowadzono benzen i energicznie wstrząśnięto zawartością naczynia. Uzyskano wówczas efekt przedstawiony na fotografii A. W drugim etapie, do powstałej mieszaniny dodano próbkę aminy i ponownie wstrząśnięto zawartością probówki, uzyskując tym samym układ, jaki ilustruje fotografia B. W warunkach przeprowadzonego eksperymentu gęstość benzenu była równa 0,87 g∙cm–3.
Napisz wniosek dotyczący rozpuszczalności bromu w wodzie oraz w benzenie wynikający z pierwszego etapu doświadczenia. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zadanie 27. Wybór naczynia zawierającego substancje obniżające napięcie powierzchniowe wody. Doświadczenia chemiczne w zadaniach część 1. Rozdział 5 (1 punkt)
Do trzech probówek zawierających olej roślinny, losowo wprowadzono roztwory wodne – KOH, HCl oraz Br2. Zawartością każdego z naczyń energicznie wstrząśnięto i praktycznie natychmiast sfotografowano (zdjęcia 1.–3.).
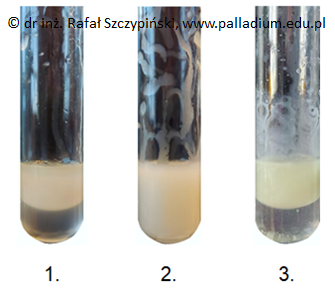
Wybierz fotografię przedstawiającą mieszaninę związków chemicznych obniżających napięcie powierzchniowe wody, powstałych w wyniku przeprowadzonego doświadczenia. Napisz wspólną nazwę tego typu pochodnych kwasów tłuszczowych. Numer fotografii: Nazwa grupy soli: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zadanie 28.1. Zapis równania procesu warunkującego odczyn roztworu. Doświadczenia chemiczne w zadaniach część 1. Rozdział 5 (1 punkt)
Przeprowadzono doświadczenie chemiczne, którego celem było odróżnienie dwóch ciekłych mieszanin oraz określenie ich odczynów. Jedną stanowił sok z kiszonej kapusty, a drugą ekstrakt z tkanki rybnej. Substancje te w sposób losowy przedstawiają fotografie A1 oraz B1. W pierwszym etapie do zawartości każdego z naczyń wprowadzono po dwie krople roztworu oranżu metylowego. Zawartość probówki A1 przyjęła barwę widoczną na fotografii A2, natomiast zawartość probówki B1 przyjęła barwę widoczną na fotografii B2.

Poniżej wymieniono nazwy kilku związków chemicznych wśród których znajduje się substancja odpowiedzialna za odczyn soku z kiszonej kapusty.
chlorek sodu kwas mrówkowy kwas mlekowy polifenole
Stosując wzór półstrukturalny (grupowy) właściwego – wybranego spośród powyższych związku chemicznego – napisz w formie jonowej skróconej równanie procesu chemicznego z jego udziałem, którego przebieg skutkuje określonym odczynem soku z kiszonej kapusty. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zadanie 28.2. Zapis równania procesu powodującego zmianę barwy uniwersalnego papierka wskaźnikowego. Doświadczenia chemiczne w zadaniach część 1. Rozdział 5 (1 punkt)
Przeprowadzono doświadczenie chemiczne, którego celem było odróżnienie dwóch ciekłych mieszanin oraz określenie ich odczynów. Jedną stanowił sok z kiszonej kapusty, a drugą ekstrakt z tkanki rybnej. Substancje te w sposób losowy przedstawiają fotografie A1 oraz B1. W pierwszym etapie do zawartości każdego z naczyń wprowadzono po dwie krople roztworu oranżu metylowego. Zawartość probówki A1 przyjęła barwę widoczną na fotografii A2, natomiast zawartość probówki B1 przyjęła barwę widoczną na fotografii B2.

Opisanym sposobem nie można w sposób jednoznaczny określić odczynu jednej z próbek poddanych analizie. Podczas drugiego etapu doświadczenia w analizowanej mieszaninie zanurzono uniwersalny papierek wskaźnikowy. Efekt końcowy tego etapu eksperymentu przedstawia zamieszczona poniżej fotografia.

Za widoczną zmianę barwy papierka wskaźnikowego odpowiada grupa związków chemicznych stanowiących produkty rozkładu aminokwasów białkowych. Wśród nich zwykle obecna jest również N,N-dimetylometanoamina.
Napisz w formie jonowej skróconej równanie procesu chemicznego, w wyniku którego związek ten powoduje widoczną zmianę barwy papierka wskaźnikowego. Zastosuj grupowe wzory odpowiednich drobin (cząsteczek, jonów). © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
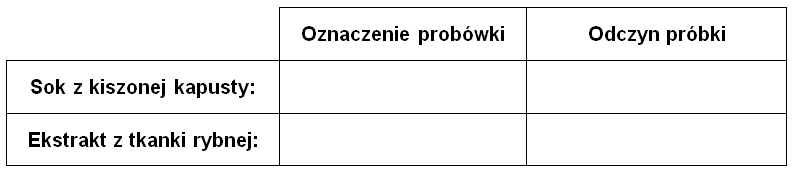
Zadanie 28.3. Przypisywanie numerów probówek do odpowiednich mieszanin. Doświadczenia chemiczne w zadaniach część 1. Rozdział 5 (1 punkt)
Przeprowadzono doświadczenie chemiczne, którego celem było odróżnienie dwóch ciekłych mieszanin oraz określenie ich odczynów. Jedną stanowił sok z kiszonej kapusty, a drugą ekstrakt z tkanki rybnej. Substancje te w sposób losowy przedstawiają fotografie A1 oraz B1. W pierwszym etapie do zawartości każdego z naczyń wprowadzono po dwie krople roztworu oranżu metylowego. Zawartość probówki A1 przyjęła barwę widoczną na fotografii A2, natomiast zawartość probówki B1 przyjęła barwę widoczną na fotografii B2.

Przypisz zawartość probówek A1 oraz B1 do odpowiednich mieszanin oraz określ odczyn (kwasowy, zasadowy, obojętny) analizowanych próbek. Uzupełnij tabelę. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone