Wskazanie wzoru odpowiedniej substancji chemicznej z uzasadnieniem równaniem reakcji chemicznej
Do wodnego roztworu pewnego związku chemicznego o żółtym zabarwieniu wprowadzono roztwór kwasu siarkowego(VI) i uzyskano układ przedstawiony na fotografii:

Wśród podanych wzorów substancji chemicznych: FeCl3, Br2, K2CrO4, KMnO4, NaCl wskaż tę, której dotyczy przeprowadzone doświadczenie. Odpowiedź uzasadnij równaniem odpowiedniej reakcji chemicznej zapisanym w formie jonowej skróconej. Wzór wybranej substancji chemicznej: Równanie reakcji: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zapis równania reakcji chemicznej oraz uzasadnienie konieczności odpowietrzenia odczynników
Do odpowietrzonego wodnego roztworu zawierającego dwudodatnie jony o konfiguracji elektronowej [Ar] 3d5, ostrożnie wprowadzono praktycznie pozbawiony tlenu roztwór wodorotlenku sodu. W wyniku przebiegającej reakcji chemicznej wytrącił się oczekiwany cielisty osad widoczny na zamieszczonej fotografii.

Napisz w formie jonowej skróconej równanie reakcji chemicznej, której przebieg doprowadził do uzyskania widocznego na zdjęciu osadu oraz wyjaśnij, dlaczego należało zastosować odpowietrzone odczynniki w celu jego otrzymania. Równanie reakcji: Wyjaśnienie: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zapis równania reakcji chemicznej oraz wyjaśnienie, dlaczego stężenie substancji jest najwyższe u wylotu z probówki
Podczas reakcji przebiegającej po wprowadzeniu roztworu kwasu siarkowego(VI) do probówki zawierającej azotan(III) sodu zawartość naczynia intensywnie pieni się z wydzieleniem bezbarwnego gazu. Zamieszczone fotografie, które zostały wykonane w pewnym odstępie czasu przedstawiają etapy opisanego doświadczenia.

Przyczyną zabarwienia fazy gazowej jest substancja o drażniącym zapachu.
Napisz równanie reakcji chemicznej, której przebieg w sposób bezpośredni skutkuje pojawieniem się opisanej barwnej substancji oraz wyjaśnij, dlaczego jej stężenie jest największe u wylotu z naczynia? Równanie reakcji: Wyjaśnienie: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Wskazanie właściwego piktogramu chemicznego opisującego własność dwuchromianu(VI) potasu wykorzystaną w reakcji chemicznej
Do znajdującego się w probówce dwuchromianu(VI) potasu dodano roztwór kwasu siarkowego(VI) o stężeniu 20%, aż do całkowitego rozpuszczenia się ciała stałego. Następnie do zawartości tego naczynia wkroplono 3-procentowy roztwór nadtlenku wodoru. Podczas wykonywania tej czynności zaobserwowano między innymi wydzielanie się bezbarwnego gazu. Uzyskana mieszanina poreakcyjna została silnie zalkalizowana roztworem KOH, po czym wprowadzono do niej roztwór nadtlenku wodoru i zaobserwowano zmianę barwy zawartości probówki. W trakcie doświadczenia wykonano kilka fotografii oznaczonych numerami I–IV.

Rysunki poniżej przedstawiają kilka wybranych piktogramów ostrzegawczych.

Wybierz spośród nich symbol tego, który opisuje własność dwuchromianu(VI) potasu, jaka została wykorzystana, w celu przekształcenia zawartości probówki IV w I. Rozwiązanie tego zadania dostępne jest nieodpłatnie pod poniższym linkiem: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie masy produktu uzyskanego w wyniku reakcji redoks z udziałem siarkowodoru oraz zakwaszonego roztworu dwuchromianu(VI) potasu
Przeprowadzono doświadczenie, którego schemat ilustruje rysunek poniżej. Podczas przebiegu tego eksperymentu zastosowano nadmiar kwasu siarkowego(VI) oraz zaobserwowano między innymi wytrącenie się żółtego osadu, który w wyniku spalenia w tlenie daje gazowy produkt o drażniącej woni. Związek ten powoduje odbarwienie zakwaszonego roztworu manganianu(VII) potasu. Zastosowane ilości siarkowodoru oraz dwuchromianu(VI) potasu były względem siebie w stosunku stechiometrycznym, a reakcja w płuczce przebiegła ze 100% wydajnością. Zebrany w cylindrze gaz X zajął objętość równą 647 cm3 (w przeliczeniu na warunki normalne).
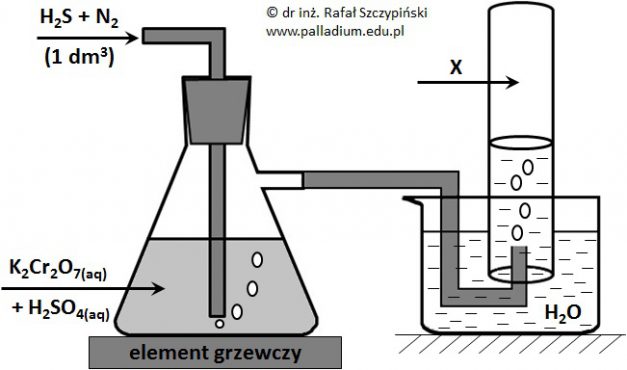
Oblicz masę żółtego osadu jaki wytrącił się w płuczce. Wynik podaj z dokładnością do pierwszego miejsca po przecinku. Rozwiązanie tego zadania dostępne jest nieodpłatnie pod poniższym linkiem: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
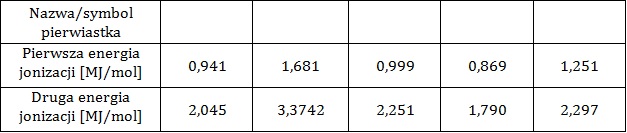
Wyjaśnienie, dlaczego druga energia jonizacji potasu jest większa niż druga energia jonizacji wapnia
Pierwszą energią jonizacji nazywamy taką ilość energii, jaką należy dostarczyć do atomu, aby oderwać od niego jeden elektron. W przypadku odrywania kolejnych elektronów mówimy wówczas kolejno o drugiej, trzeciej oraz n-tej energii jonizacji. W tabeli zebrano dane na temat wartości pierwszej i drugiej energii jonizacji pięciu kolejnych litowców.
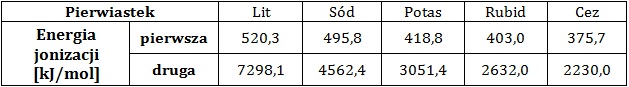
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2010.
Druga energia jonizacji potasu ma wartość ponad 2,5-krotnie większą od drugiej energii jonizacji wapnia.
Wyjaśnij, jaka jest tego przyczyna? Rozwiązanie tego zadania dostępne jest nieodpłatnie pod poniższym linkiem: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Wyjaśnienie, dlaczego pierwsza energia jonizacji ma mniejszą wartość od drugiej energii jonizacji
Pierwszą energią jonizacji nazywamy taką ilość energii, jaką należy dostarczyć do atomu, aby oderwać od niego jeden elektron. W przypadku odrywania kolejnych elektronów mówimy wówczas kolejno o drugiej, trzeciej oraz n-tej energii jonizacji. W tabeli zebrano dane na temat wartości pierwszej i drugiej energii jonizacji pięciu kolejnych litowców.

Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2010.
Wyjaśnij, dlaczego pierwsza energia jonizacji ma zawsze mniejszą wartość od wartości drugiej energii jonizacji? © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Uzasadnienie zmiany wartości energii jonizacji u kolejnych litowców
Pierwszą energią jonizacji nazywamy taką ilość energii, jaką należy dostarczyć do atomu, aby oderwać od niego jeden elektron. W przypadku odrywania kolejnych elektronów mówimy wówczas kolejno o drugiej, trzeciej oraz n-tej energii jonizacji. W tabeli zebrano dane na temat wartości pierwszej i drugiej energii jonizacji pięciu kolejnych litowców.

Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2010.
Wyjaśnij, dlaczego wartość pierwszej energii jonizacji maleje wraz ze wzrostem masy atomowej litowca? © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone