Zapis równania reakcji jądrowej z udziałem cząstki alfa. Zadanie 5. Arkusz CKE chemia próbny grudzień 2024 rozszerzony (1 punkt)
Poniżej przedstawiono przebieg przemiany jądrowej, która zachodzi w wyniku bombardowania jąder pewnego izotopu uranu przyśpieszonymi cząstkami 𝛼.
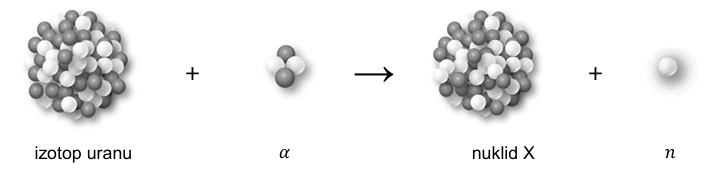
Powstający nuklid X jest nietrwały i ulega rozpadowi β–, którego produktem jest izotop ameryku 241Am.
Na podstawie: A. Czerwiński, Energia jądrowa i promieniotwórczość, Warszawa 1998.
Napisz równanie opisanej przemiany jądrowej, w której powstaje nuklid X. Uzupełnij wszystkie pola w poniższym schemacie. Zastosuj symbole chemiczne pierwiastków.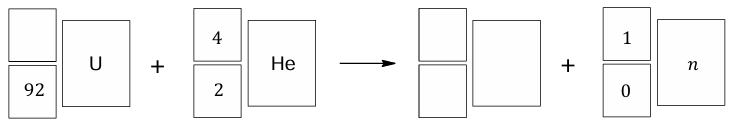
Zapis wzoru sumarycznego oraz wyjaśnienie przyczyny w różnicach promieni jonowych. Zadanie 6.1. Arkusz CKE chemia próbny grudzień 2024 rozszerzony (2 punkty)
Dwa pierwiastki umownie oznaczone symbolami E i X tworzą jony proste o wzorach E2+ i X2–. Oba te jony mają konfigurację neonu. Na poniższym modelu przedstawiono budowę kryształu substancji o wzorze ogólnym EX.
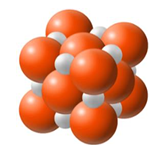
Napisz wzór związku, którego model przedstawiono powyżej. Użyj symboli chemicznych pierwiastków. Wzór związku: Wyjaśnij, dlaczego jon E2+ ma mniejszy promień niż jon X2–. W wyjaśnieniu odwołaj się do budowy tych jonów. Wyjaśnienie:
Rozstrzygnięcie możliwości przewodnictwa elektrycznego przez krystaliczny związek jonowy. Zadanie 6.2. Arkusz CKE chemia próbny grudzień 2024 rozszerzony (1 punkt)
Dwa pierwiastki umownie oznaczone symbolami E i X tworzą jony proste o wzorach E2+ i X2–. Oba te jony mają konfigurację neonu. Na poniższym modelu przedstawiono budowę kryształu substancji o wzorze ogólnym EX.

Rozstrzygnij, czy krystaliczna substancja EX jest przewodnikiem czy izolatorem prądu elektrycznego. Odpowiedź uzasadnij. Rozstrzygnięcie: Uzasadnienie:
Obliczanie stężeniowej stałej równowagi reakcji rozkładu chlorku fosforu(V). Zadanie 7.1. Arkusz CKE chemia próbny grudzień 2024 rozszerzony (4 punkty) zadanie problemowe
Chlorek fosforu(V) o wzorze PCl5 ulega rozkładowi zgodnie z równaniem:
PCl5 (g) ⇄ PCl3 (g) + Cl2 (g) ΔH > 0
Do cylindrycznego reaktora z ruchomym tłokiem wprowadzono 25,0 g stałego chlorku fosforu(V) i wypompowano całe powietrze. Zawartość reaktora ogrzano do temperatury 260 °C, co początkowo spowodowało sublimację całego chlorku fosforu(V), a w dalszej kolejności jego rozkład termiczny. W układzie utrzymywano stałe ciśnienie równe 1013 hPa, natomiast zmianie ulegała objętość mieszaniny gazów w reaktorze. W chwili 𝑡 w układzie ustaliła się równowaga. Gęstość równowagowej mieszaniny gazów w reaktorze wynosiła d = 2,63 g∙dm−3.
Na podstawie: W. Mizerski, Tablice chemiczne, Warszawa 2013.
Oblicz wartość stężeniowej stałej równowagi reakcji dysocjacji termicznej chlorku fosforu(V) w temperaturze 260 °C. Przyjmij: R = 83,14 hPa∙dm3∙mol–1∙K–1, MPCl5 = 208,5 g∙mol–1, MPCl3 = 137,5 g∙mol–1.
Wybór właściwego wykresu oraz uzasadnienie dwoma argumentami. Zadanie 7.2. Arkusz CKE chemia próbny grudzień 2024 rozszerzony (2 punkty)
Chlorek fosforu(V) o wzorze PCl5 ulega rozkładowi zgodnie z równaniem:
PCl5 (g) ⇄ PCl3 (g) + Cl2 (g) ΔH > 0
Na poniższym wykresie przedstawiono zmianę stężenia molowego chlorku fosforu(V) PCl5 w trakcie – opisanej w informacji wstępnej – reakcji prowadzonej w temperaturze 260 °C.
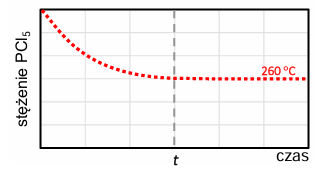
Tę reakcję przeprowadzono ponownie w tym samym reaktorze. Zmieniono jedynie temperaturę, w której znajdował się układ – wynosiła ona 400 °C. Poniżej zestawiono wykresy przedstawiające zależność stężenia PCl5 od czasu. Osie na wszystkich wykresach są wyskalowane tak samo.
Rozstrzygnij, na którym z poniższych wykresów (1.–4.) niebieska linia przedstawia zmianę stężenia molowego chlorku fosforu(V) PCl5 w trakcie reakcji prowadzonej w wyższej temperaturze. Odpowiedź uzasadnij – zapisz dwa różne argumenty. Rozstrzygnięcie: Argumenty: 1. 2.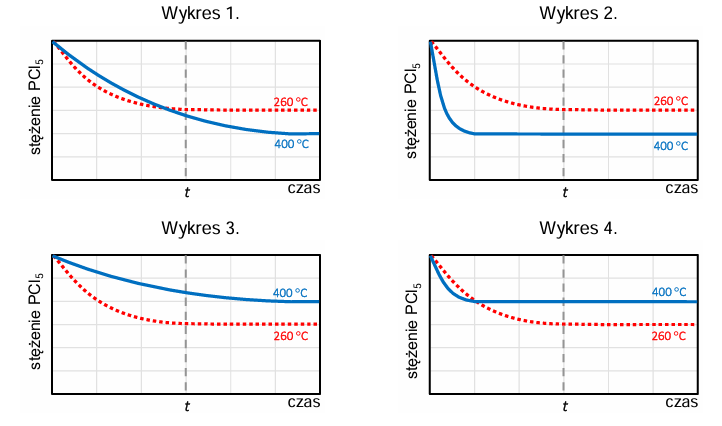
Wybór właściwych danych dotyczących kinetyki reakcji. Zadanie 8. Arkusz CKE chemia próbny grudzień 2024 rozszerzony (1 punkt)
Zbadano, jak w warunkach izotermicznych (𝑇 = const) stężenia reagentów X i Y wpływają na szybkość reakcji chemicznej:
X (g) + Y (g) → XY (g)
Ogólne równanie kinetyczne opisanej reakcji ma postać
![]()
Ustalono, że:
– stężenie reagenta X nie ma wpływu na szybkość reakcji,
– szybkość reakcji zależy od stężenia reagenta Y w sposób przedstawiony na wykresie.
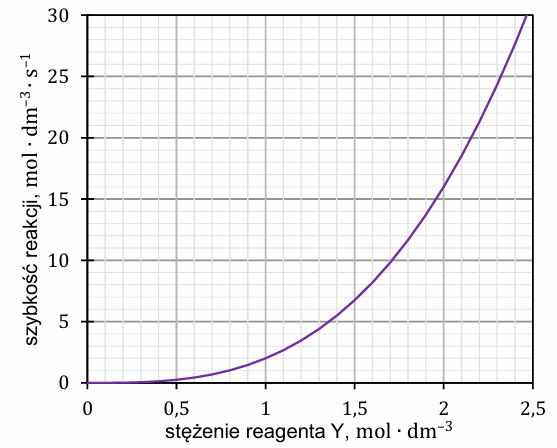
Uzupełnij zdania. Zaznacz jedną odpowiedź spośród podanych w każdym nawiasie. Dla opisanej reakcji wartość liczbowa wykładnika 𝒂 w równaniu kinetycznym jest równa (0 / 1 / 2), natomiast wykładnika 𝒃 jest równa (1 / 2 / 3). Jeżeli w warunkach izotermicznych pojemność reaktora, w którym jest prowadzona reakcja, zostanie zwiększona, to szybkość reakcji (wzrośnie / zmaleje / nie ulegnie zmianie).
Wybór wzoru soli oraz zapis równań reakcji chemicznych. Zadanie 9. Arkusz CKE chemia próbny grudzień 2024 rozszerzony (2 punkty)
Przeprowadzono doświadczenie, w którym do probówki z wodnym roztworem soli pewnego metalu M (zdjęcie 1.), wprowadzono wodny roztwór wodorotlenku potasu o niewielkim stężeniu (etap I) i stwierdzono, że wytrącony osad nie roztwarza się w nadmiarze odczynnika (zdjęcie 2.). Do otrzymanej mieszaniny wkroplono stężony wodny roztwór amoniaku (etap II). W wyniku reakcji powstały jony o wzorze [M(NH3)4]2+. Wygląd zawartości probówki po zakończeniu doświadczenia przedstawiono na zdjęciu 3.

Spośród soli, których wzory wymieniono poniżej, zaznacz tę, której roztwór mógł znajdować się w probówce na początku doświadczenia. AgNO3 CrCl3 CuSO4 FeCl3 MnSO4 Napisz w formie jonowej skróconej równanie reakcji, która zaszła w etapie I opisanego doświadczenia: Napisz w formie jonowej równanie reakcji, która zaszła w etapie II opisanego doświadczenia:
Ustalanie wzoru tlenku żelaza. Zadanie 10.1. Arkusz CKE chemia próbny grudzień 2024 rozszerzony (2 punkty)
Wodorotlenki metali ciężkich są nietrwałe i łatwo ulegają rozkładowi. W celu zbadania jednej z takich reakcji przeprowadzono następujące doświadczenie: w warunkach beztlenowych z roztworu FeCl2 wytrącono wodorotlenek żelaza(II). Po pewnym czasie stwierdzono, że z mieszaniny poreakcyjnej wydziela się bezbarwny gaz, który zapala się wybuchowo. Po ustaniu objawów reakcji jej stały produkt odsączono i całkowicie usunięto z niego wodę. Badanie składu tego związku wykazało, że jest to tlenek, zawierający 72,36 % masowych żelaza.
Na podstawie: M. Ma, Y. Zhang, Z. Gou i N. Gu, Nanoscale Research Letters, 8 (2013) 16.
Na podstawie obliczeń ustal wzór otrzymanego tlenku żelaza.
Zapis równania reakcji rozkładu wodorotlenku żelaza(II) w podanych warunkach. Zadanie 10.2. Arkusz CKE chemia próbny grudzień 2024 rozszerzony (1 punkt)
Wodorotlenki metali ciężkich są nietrwałe i łatwo ulegają rozkładowi. W celu zbadania jednej z takich reakcji przeprowadzono następujące doświadczenie: w warunkach beztlenowych z roztworu FeCl2 wytrącono wodorotlenek żelaza(II). Po pewnym czasie stwierdzono, że z mieszaniny poreakcyjnej wydziela się bezbarwny gaz, który zapala się wybuchowo. Po ustaniu objawów reakcji jej stały produkt odsączono i całkowicie usunięto z niego wodę. Badanie składu tego związku wykazało, że jest to tlenek, zawierający 72,36 % masowych żelaza.
Na podstawie: M. Ma, Y. Zhang, Z. Gou i N. Gu, Nanoscale Research Letters, 8 (2013) 16.
Napisz w formie cząsteczkowej równanie reakcji rozkładu wodorotlenku żelaza(II), której produktem jest opisany tlenek.
Zapis równania reakcji całkowitego spalania butan-1-olu. Zadanie 11.1. Arkusz CKE chemia próbny grudzień 2024 rozszerzony (1 punkt)
Molową entalpię spalania butan-1-olu można wyznaczyć doświadczalnie. W tym celu szklany palnik napełnia się butan-1-olem, a następnie waży. Za pomocą tak przygotowanego palnika ogrzewa się kolbę zawierającą wodę o znanej masie. Proces spalania alkoholu prowadzi się przez pewien czas, przy czym stale kontroluje się za pomocą termometru temperaturę wody w kolbie. Na zakończenie doświadczenia palnik waży się powtórnie.
Przeprowadzono opisane doświadczenie i na podstawie zmiany temperatury wody określono, że w tym doświadczeniu woda pobrała 𝑄=50 400 J energii cieplnej pochodzącej ze spalania butan-1-olu.
W tabeli poniżej zestawiono dane z pomiaru masy palnika podczas doświadczenia.

Napisz równanie reakcji spalania całkowitego butan-1-olu. Zastosuj wzory sumaryczne substratów i produktów.
Obliczanie molowej entalpii spalania butan-1-olu. Zadanie 11.2. Arkusz CKE chemia próbny grudzień 2024 rozszerzony (2 punkty)
Molową entalpię spalania butan-1-olu można wyznaczyć doświadczalnie. W tym celu szklany palnik napełnia się butan-1-olem, a następnie waży. Za pomocą tak przygotowanego palnika ogrzewa się kolbę zawierającą wodę o znanej masie. Proces spalania alkoholu prowadzi się przez pewien czas, przy czym stale kontroluje się za pomocą termometru temperaturę wody w kolbie. Na zakończenie doświadczenia palnik waży się powtórnie.
Przeprowadzono opisane doświadczenie i na podstawie zmiany temperatury wody określono, że w tym doświadczeniu woda pobrała 𝑄=50 400 J energii cieplnej pochodzącej ze spalania butan-1-olu.
W tabeli poniżej zestawiono dane z pomiaru masy palnika podczas doświadczenia.

Na podstawie efektu cieplnego reakcji (𝑄) można obliczyć entalpię reakcji (Δ𝐻).
Oblicz molową entalpię spalania butan-1-olu. Pomiń straty ciepła. Wynik zapisz w zaokrągleniu do liczb całkowitych oraz z jednostką kJ·mol‒1. Uwzględnij odpowiedni znak entalpii reakcji.
Zapis równania reakcji usuwania przemijającej twardości wody. Zadanie 12. Arkusz CKE chemia próbny grudzień 2024 rozszerzony (1 punkt)
W wyniku kontaktu ze skałami i z glebą woda wzbogaca się m.in. w związki wapnia. Obecność tych związków w wodzie jest przyczyną zwiększonej twardości. Twardość węglanową (przemijającą) można usunąć przez gotowanie, co prowadzi do przechodzenia wodorowęglanu wapnia w osad węglanu.
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2018.
Napisz w formie jonowej równanie reakcji, która zachodzi podczas gotowania twardej wody zawierającej wodorowęglan wapnia.
Wybór właściwych słów dotyczących kalcytu oraz aragonitu. Zadanie 13. Arkusz CKE chemia próbny grudzień 2024 rozszerzony (1 punkt)
W wyniku kontaktu ze skałami i z glebą woda wzbogaca się m.in. w związki wapnia. Obecność tych związków w wodzie jest przyczyną zwiększonej twardości. Twardość węglanową (przemijającą) można usunąć przez gotowanie, co prowadzi do przechodzenia wodorowęglanu wapnia w osad węglanu.
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2018.
Głównym składnikiem skał wapiennych jest związek chemiczny, występujący w dwóch odmianach krystalicznych, znanych jako kalcyt i aragonit. Na poniższym wykresie przedstawiono zależność iloczynu rozpuszczalności (𝐾s) kalcytu i aragonitu od temperatury. Iloczyn rozpuszczalności jest wyrażony jako p𝐾s (p𝐾s = –log 𝐾s).
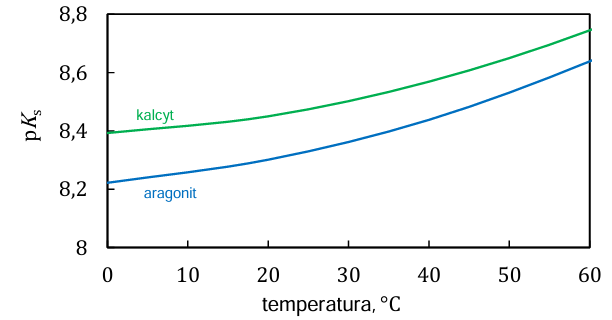
Na podstawie: L.N. Plummer, E. Busenberg, Geochimica et Cosmochimica Acta, 46 (1982) 6.
Uzupełnij poniższe zdania. Zaznacz jedną odpowiedź spośród podanych w każdym nawiasie. Wraz ze wzrostem temperatury rozpuszczalność kalcytu i aragonitu w wodzie (rośnie / maleje). W danej temperaturze rozpuszczalność aragonitu jest (większa / mniejsza) niż rozpuszczalność kalcytu.
Obliczanie pH roztworu uzyskanego w wyniku reakcji chemicznej. Zadanie 14. Arkusz CKE chemia próbny grudzień 2024 rozszerzony (2 punkty)
Do 400 cm3 roztworu kwasu azotowego(V) o pH = 2,5 wprowadzono 120,0 mg tlenku wapnia, który po chwili roztworzył się całkowicie. Doświadczenie wykonano w temperaturze t = 25 oC .
Oblicz pH otrzymanego roztworu. Załóż, że dodatek tlenku wapnia nie zmienił objętości roztworu. Wynik zapisz w zaokrągleniu do jednego miejsca po przecinku.



