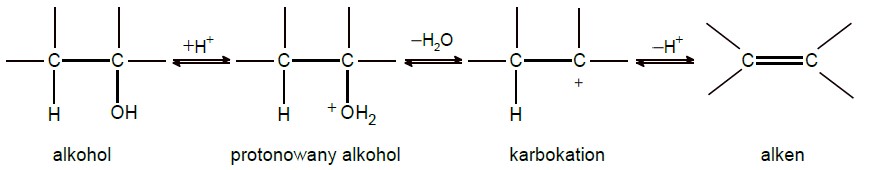
Przypisanie nazwy alkoholu do odpowiedniej probówki. Zadanie 45. Informator CKE chemia 2023 rozszerzony (1 punkt)
W dwóch probówkach A i B znajdują się oddzielnie dwa alkohole: 2-metylopropan-2-ol i butan-1-ol. Do obu probówek dodano wodny roztwór manganianu(VII) potasu i parę kropli wodnego roztworu kwasu siarkowego(VI). Następnie zawartość probówek dokładnie wymieszano. Po pewnym czasie od wykonania doświadczeń roztwory w próbówkach wyglądały tak jak na zdjęciach poniżej:

Podaj nazwę alkoholu, który znajdował się w probówce A. Odpowiedź uzasadnij. Nazwa alkoholu: Uzasadnienie:
Wybór par związków stanowiących enancjomery i diastereoizomery. Zadanie 47.1. Informator CKE chemia 2023 rozszerzony (1 punkt)
Poniżej przedstawiono wzory Fischera trzech stereoizomerów kwasu winowego (2,3-dihydroksybutanodiowego).
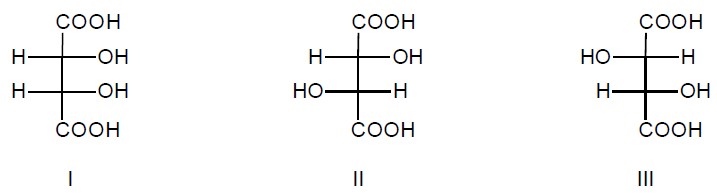
Uzupełnij poniższe zdanie. Wybierz i zaznacz właściwe określenie w każdym nawiasie. Związki I i II są (enancjomerami / diastereoizomerami), a związki II i III stanowią parę (enancjomerów / diastereoizomerów).
Przypisanie właściwego stereoizomeru do odpowiadających mu właściwości fizycznych. Zadanie 47.2. Informator CKE chemia 2023 rozszerzony (1 punkt)
Poniżej przedstawiono wzory Fischera trzech stereoizomerów kwasu winowego (2,3-dihydroksybutanodiowego).

Wymienionym w tabeli właściwościom fizycznym substancji przyporządkuj wzory właściwych stereoizomerów (I i II) – wpisz ich numery. Dla stereoizomeru III wpisz w tabeli przewidywane wartości temperatury topnienia, rozpuszczalności i skręcalności właściwej.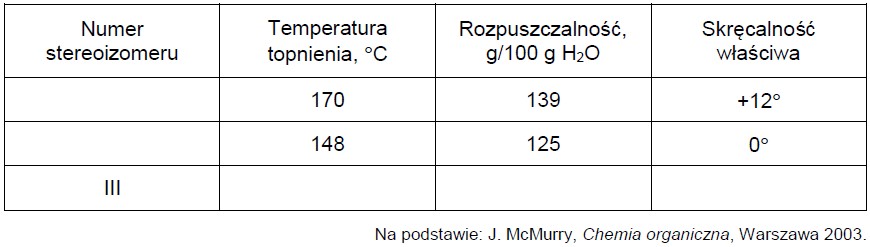
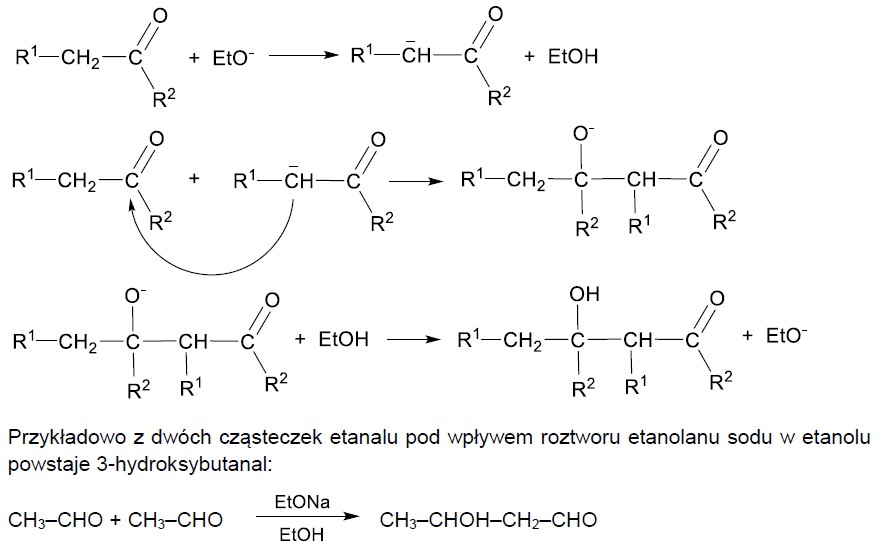
Zapis wzoru nieorganicznego produktu reakcji w procesie syntezy błękitu indygo. Zadanie 48.1. Informator CKE chemia 2023 rozszerzony (1 punkt)
Błękit indygo jest naturalnym barwnikiem, który w końcu XIX w. zaczęto otrzymywać syntetycznie. W jednej z opracowanych wtedy metod produkcji tego związku surowcem była pochodna glicyny, N-(2-karboksyfenylo)glicyna (związek I). Ten substrat w pierwszym etapie syntezy ogrzewano z NaOH, co prowadziło do zamknięcia pierścienia pięcioczłonowego.

Tę reakcję opisuje schemat:
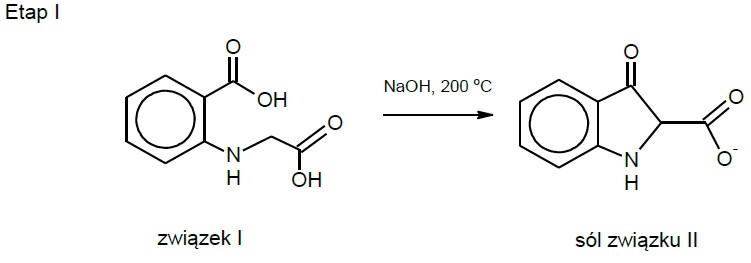
Otrzymaną mieszaninę zakwaszono w celu utworzenia związku II. W drugim etapie syntezy zachodziła dekarboksylacja związku II oraz pewien proces X, w którym uczestniczył tlen z powietrza. Reakcje te prowadziły do powstania indyga, zgodnie ze schematem:
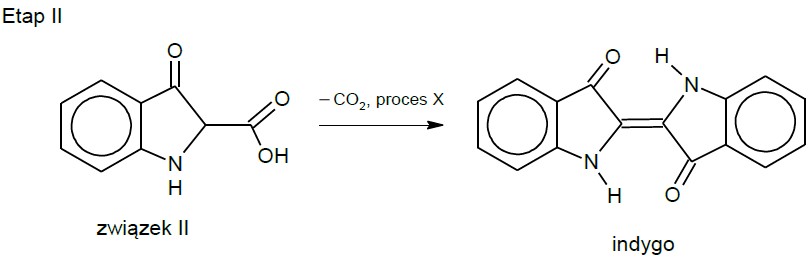
Napisz wzór nieorganicznego produktu ubocznego pierwszego etapu syntezy.
Wskazanie stosunku molowego tlenu do drugiego z substratów w procesie syntezy błękitu indygo. Zadanie 48.2. Informator CKE chemia 2023 rozszerzony (1 punkt)
Błękit indygo jest naturalnym barwnikiem, który w końcu XIX w. zaczęto otrzymywać syntetycznie. W jednej z opracowanych wtedy metod produkcji tego związku surowcem była pochodna glicyny, N-(2-karboksyfenylo)glicyna (związek I). Ten substrat w pierwszym etapie syntezy ogrzewano z NaOH, co prowadziło do zamknięcia pierścienia pięcioczłonowego.

Tę reakcję opisuje schemat:

Otrzymaną mieszaninę zakwaszono w celu utworzenia związku II. W drugim etapie syntezy zachodziła dekarboksylacja związku II oraz pewien proces X, w którym uczestniczył tlen z powietrza. Reakcje te prowadziły do powstania indyga, zgodnie ze schematem:

Podaj stosunek molowy tlenu O2 do związku II w reakcji zachodzącej podczas procesu X.
Wskazanie atomów tlenu biorących udział w tworzeniu wiązań glikozydowych. Zadanie 49.1. Informator CKE chemia 2023 rozszerzony (1 punkt)
Agar to substancja żelująca wytwarzana z krasnorostów. W jej skład wchodzi m.in. agaroza – polisacharyd, który jest polimerem β-D-galaktozy i α-3,6-anhydro-L-galaktozy.
Wiązanie O-glikozydowe powstaje w wyniku kondensacji dwóch grup –OH należących do dwóch cząsteczek monosacharydów, przy czym przynajmniej jedna z tych grup związana była z anomerycznym (półacetalowym) atomem węgla w cząsteczce monosacharydu. 3,6-anhydrogalaktoza powstaje w wyniku kondensacji grup hydroksylowych znajdujących się przy 3. i 6. atomie węgla cząsteczki galaktozy prowadzącej do oderwania cząsteczki wody.
Na poniższym schemacie budowy fragmentu łańcucha agarozy zakreśl atomy tlenu uczestniczące w tworzeniu wiązań O-glikozydowych. Napisz sumaryczny wzór α-3,6-anhydrogalaktozy. Wzór sumaryczny α-3,6-anhydro-L-galaktozy: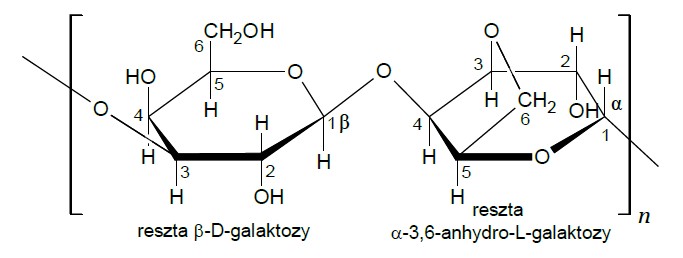
Rysowanie wzoru Hawortha β-D-galaktozy. Zadanie 49.2. Informator CKE chemia 2023 rozszerzony (1 punkt)
Agar to substancja żelująca wytwarzana z krasnorostów. W jej skład wchodzi m.in. agaroza – polisacharyd, który jest polimerem β-D-galaktozy i α-3,6-anhydro-L-galaktozy. Schemat struktury tego polisacharydu ilustruje rysunek:

Uzupełnij poniższy schemat tak, aby przedstawiał wzór β-D-galaktozy (β-D-galaktopiranozy).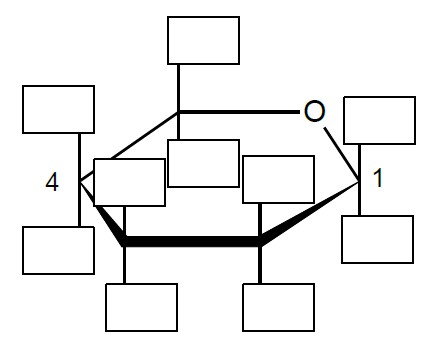
Wybór poprawnych określeń dotyczących agaru. Zadanie 49.3. Informator CKE chemia 2023 rozszerzony (2 punkty)
Agar to substancja żelująca wytwarzana z krasnorostów. W jej skład wchodzi m.in. agaroza – polisacharyd, który jest polimerem β-D-galaktozy i α-3,6-anhydro-L-galaktozy. Schemat struktury tego polisacharydu ilustruje rysunek:

Uzupełnij poniższe zdania. Wybierz i zaznacz jedno określenie spośród podanych w każdym nawiasie. Agar dobrze rozpuszcza się w gorącej wodzie i tworzy (roztwór właściwy / układ koloidalny). Stygnąc, przyjmuje postać (zolu / żelu). Takie właściwości agaru są możliwe dzięki oddziaływaniu jego cząsteczek z cząsteczkami wody polegającym na tworzeniu licznych wiązań (jonowych / kowalencyjnych / wodorowych). Podobne właściwości wykazuje otrzymywana z kości i skór zwierząt rzeźnych żelatyna, która jest (białkiem / dekstryną / polisacharydem).
Wybór odpowiednich piktogramów dla kwasu azotowego(V). Zadanie 50. Informator CKE chemia 2023 rozszerzony (2 punkty)
Poniżej przedstawiono wybrane piktogramy stosowane do oznaczania niebezpiecznych substancji i mieszanin.
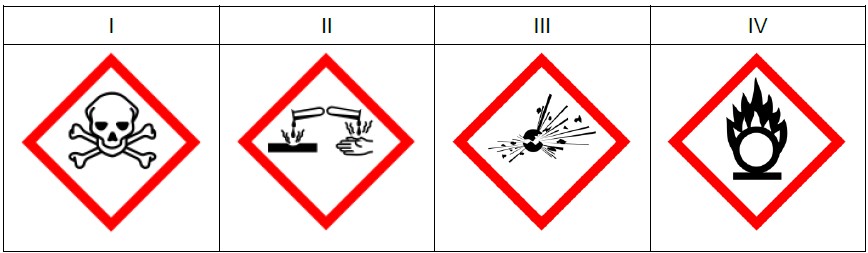
Spośród przedstawionych piktogramów wybierz dwa stosowane do opisu zagrożeń wynikających ze stosowania w laboratorium kwasu azotowego(V). Uzupełnij tabelę – wpisz oznaczenia cyfrowe wybranych piktogramów i zaznacz literę wskazującą znaczenie danego piktogramu.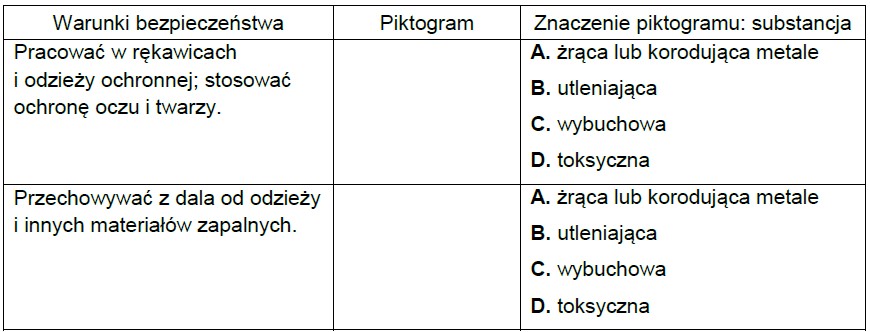
Obliczanie procentu wagowego diwodoroortofosforanu(V) wapnia w superfosfacie. Zadanie 51. Informator CKE chemia 2023 rozszerzony (2 punkty)
Superfosfat jest nawozem sztucznym zawierającym diwodoroortofosforan(V) wapnia (Ca(H2PO4)), siarczan(VI) wapnia (CaSO4) oraz zanieczyszczenia niezawierające wapnia i siarki. W superfosfacie zawartość procentowa siarki wynosi 11,9%, a zawartość procentowa wapnia jest równa 22,2%.
Oblicz w procentach masowych zawartość diwodoroortofosforanu(V) wapnia w superfosfacie.